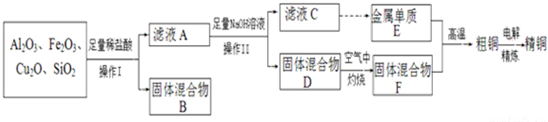
题目内容
4.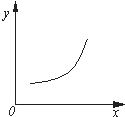 汽车尾气净化中的反应为2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.8kJ•mol-1.该反应在恒容的密闭容器中达到平衡后,若仅改变下图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
汽车尾气净化中的反应为2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.8kJ•mol-1.该反应在恒容的密闭容器中达到平衡后,若仅改变下图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )| 选项 | x | y |
| A | 压强 | 气体的平均相对分子质量 |
| B | 温度 | 平衡常数K |
| C | NO的浓度 | NO的转化率 |
| D | 温度 | 容器内混合气体的密度 |
| A. | A | B. | B | C. | C | D. | D |
分析 2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.8kJ•mol-1反应是气体体积减小的放热反应,分析图象随x增大y增大,结合化学平衡移动原理分析选项.
解答 解:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.8kJ•mol-1反应是气体体积减小的放热反应;
A、若x为压强,随压强增大,平衡正向移动,总质量不变,总物质的量减小,则气体的平均相对分子质量随之增大,图象变化趋势符合,故A正确;
B、若x为温度,随温度升高平衡逆向进行,则平衡常数K减小,图象变化趋势错误,故B错误;
C、若x为NO的浓度,随NO的浓度增大,平衡正向进行,但NO的转化率减小,图象变化趋势错误,故C错误;
D、若x为温度,随温度升高平衡逆向进行,气体质量不变,体积不变,密度不变,图象曲线变化趋势错误,故D错误;
故选A.
点评 本题考查了化学平衡影响因素分析判断,注意平衡常数随温度变化,题目难度中等.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
15.加强空气质量检测,客观分析空气中污染物的来源及性质,将有助于制定有针对性的治理措施.下表是某城市某日的空气质量报告:
该市某校研究性学习小组对表中首要污染物SO2导致酸雨的成因进行了如下探究:
(1)用下图所示装置进行实验.
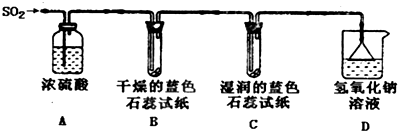
①A装置的作用是干燥.
②实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变成红色,说明SO2与水反应生成一种酸,其化学反应方程式是S02+H20?H2S03.
③D装置的作用是吸收多余SO2气体,避免污染空气,
D中发生反应的化学方程式是S02+2NaOH=Na2S03+H20.
(2)往盛有水的烧杯中通入SO2气体,测得所得溶液的pH<7(填“>”“=”或“<”),然后每隔1h测定其pH,发现pH逐渐变小(填“变大”或“变小”),直至恒定,原因是2H2SO3+O2=4H++2SO42-(写出反应的离子方程式).
(3)SO2形成酸雨的另一途径为:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4,则在此过程中的飘尘是作为催化剂(填“催化剂”或“氧化剂”).
(4)SO2与空气中的氧气、水反应生成硫酸而形成酸雨.该市可能易出现酸雨.汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为HNO3,是造成酸雨的另一主要原因.
| 污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
| 55 | SO2 | II | 良 |
(1)用下图所示装置进行实验.

①A装置的作用是干燥.
②实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变成红色,说明SO2与水反应生成一种酸,其化学反应方程式是S02+H20?H2S03.
③D装置的作用是吸收多余SO2气体,避免污染空气,
D中发生反应的化学方程式是S02+2NaOH=Na2S03+H20.
(2)往盛有水的烧杯中通入SO2气体,测得所得溶液的pH<7(填“>”“=”或“<”),然后每隔1h测定其pH,发现pH逐渐变小(填“变大”或“变小”),直至恒定,原因是2H2SO3+O2=4H++2SO42-(写出反应的离子方程式).
(3)SO2形成酸雨的另一途径为:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4,则在此过程中的飘尘是作为催化剂(填“催化剂”或“氧化剂”).
(4)SO2与空气中的氧气、水反应生成硫酸而形成酸雨.该市可能易出现酸雨.汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为HNO3,是造成酸雨的另一主要原因.
19.500ml 2mol/L的MgCl2溶液中含有氯离子的物质的量是( )
| A. | 1 mol | B. | 2 mol | C. | 3 mol | D. | 1000 mol |
16.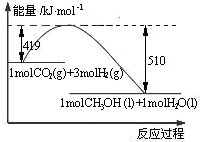 5、常温下,反应CO2(g)+3H2(g)?CH3OH(l)+H2O(l)的能量变化如图所示.反应达到平衡后,要使该反应化学平衡向右移动,其他条件不变,可采取的措施是( )
5、常温下,反应CO2(g)+3H2(g)?CH3OH(l)+H2O(l)的能量变化如图所示.反应达到平衡后,要使该反应化学平衡向右移动,其他条件不变,可采取的措施是( )
 5、常温下,反应CO2(g)+3H2(g)?CH3OH(l)+H2O(l)的能量变化如图所示.反应达到平衡后,要使该反应化学平衡向右移动,其他条件不变,可采取的措施是( )
5、常温下,反应CO2(g)+3H2(g)?CH3OH(l)+H2O(l)的能量变化如图所示.反应达到平衡后,要使该反应化学平衡向右移动,其他条件不变,可采取的措施是( )| A. | 升高温度 | B. | 分离出甲醇 | ||
| C. | 缩小反应器体积 | D. | 使用合适的催化剂 |
13.下列配合物的配位数不是6的是( )
| A. | K2[Co(NCS)3]Cl | B. | Na2[SiF2Cl2Br2] | C. | Na3[AlF6] | D. | [Cr(NH3)4(H2O)2]Cl3 |
14.电解100mL含c(H+)=0.30mol/L的下列各溶液,当电路中通过0.04mol电子时,理论上获得的阴极产物物质的量最大的是( )
| A. | 0.20 mol/L Ag+ | B. | 0.20 mol/L Al3+ | C. | 0.20 mol/L Cu2+ | D. | 0.20 mol/L Mg2+ |
 X、Y、Z、W、R是原子序数依次增大的前四周期元素.X的单质在Y2中燃烧可生成XY和XY2两种气体;Z的单质在Y2中燃烧的产物ZY2可使品红溶液褪色;W的单质是黄绿色的有毒气体;R3+离子的3d轨道半充满.请回答下列问题:
X、Y、Z、W、R是原子序数依次增大的前四周期元素.X的单质在Y2中燃烧可生成XY和XY2两种气体;Z的单质在Y2中燃烧的产物ZY2可使品红溶液褪色;W的单质是黄绿色的有毒气体;R3+离子的3d轨道半充满.请回答下列问题:
 ,反应类型是加聚反应.
,反应类型是加聚反应.