题目内容
14.电解100mL含c(H+)=0.30mol/L的下列各溶液,当电路中通过0.04mol电子时,理论上获得的阴极产物物质的量最大的是( )| A. | 0.20 mol/L Ag+ | B. | 0.20 mol/L Al3+ | C. | 0.20 mol/L Cu2+ | D. | 0.20 mol/L Mg2+ |
分析 在电解池中,阴极上阳离子的放电顺序是:银离子>铜离子>氢离子,只有放电顺序在H+前的才析出金属,根据电极反应结合电子守恒来计算即可.
解答 解:Al3+和Mg2+的放电顺序都在H+后面,所以含有这两种阳离子的盐溶液中,阴极上放出H2,而含有银离子和铜离子这两种阳离子的盐溶液中,Ag和Cu金属先在阴极析出.
A、0.20mol∕LAg+在氢离子之前放电,金属银的质量是 0.2mol/L×0.1L×108g/mol=2.16g;
B、Al3+的放电顺序在H+后面,所以含有这种阳离子的盐溶液中,阴极上放出H2,不会析出金属;
C、铜离子先放电,100mL0.20mol∕LCu2+就会得到0.04mol电子,所以析出金属铜的质量为:$\frac{1}{2}$×0.02mol×64g/mol=0.64g;
D、Mg2+的放电顺序在H+后面,所以含有这种阳离子的盐溶液中,阴极上放出H2,不会析出金属.
所以析出金属质量最大的是0.20mol∕LAg+.
故选A.
点评 本题考查学生电解池上阴极上离子的放电顺序并结合电子守恒来计算析出金属的质量,综合性较强,难度较大.

练习册系列答案
相关题目
4.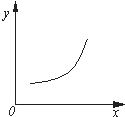 汽车尾气净化中的反应为2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.8kJ•mol-1.该反应在恒容的密闭容器中达到平衡后,若仅改变下图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
汽车尾气净化中的反应为2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.8kJ•mol-1.该反应在恒容的密闭容器中达到平衡后,若仅改变下图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
 汽车尾气净化中的反应为2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.8kJ•mol-1.该反应在恒容的密闭容器中达到平衡后,若仅改变下图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
汽车尾气净化中的反应为2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.8kJ•mol-1.该反应在恒容的密闭容器中达到平衡后,若仅改变下图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )| 选项 | x | y |
| A | 压强 | 气体的平均相对分子质量 |
| B | 温度 | 平衡常数K |
| C | NO的浓度 | NO的转化率 |
| D | 温度 | 容器内混合气体的密度 |
| A. | A | B. | B | C. | C | D. | D |
2.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,下列反应可制取K2FeO4:2Fe(OH)3+3Cl2+10KOH═2K2FeO4+6KCl+8H2O.对于该反应,下列说法正确的是( )
| A. | 该反应是置换反应 | |
| B. | 该反应只有K2FeO4为氧化产物 | |
| C. | 3mol氯气参与反应转移电子数为6个 | |
| D. | 该反应条件下K2FeO4的氧化性大于Cl2 |
6.以下除杂方案不正确的是( )
| A. | Cl2中混有HCl,可依次通入盛有饱和食盐水、浓H2SO4的洗气瓶 | |
| B. | NH4Cl 溶液中混有Fe3+,可加入NaOH溶液后过滤 | |
| C. | CO中混有CO2,可依次通入盛NaOH 溶液、浓 H2SO4的洗气瓶 | |
| D. | Na2CO3固体中混有NaHCO3,可用灼烧的方法除尽 |
3.下列说法正确的是( )
| A. | SiO2是酸性氧化物,能与NaOH溶液反应 | |
| B. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| C. | 硫化亚铁溶于稀硝酸中的离子方程式为:FeS+2H+═Fe2++H2S↑ | |
| D. | pH=1的溶液中:Fe2+、NO3-、SO42-、Na+能够大量共存 |
4.物质的量之比为1:3的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,下列说法正确的是( )
| A. | 在此反应中硝酸体现强氧化性,全部被还原 | |
| B. | 向反应后的溶液中再加入金属铁,不再发生化学反应 | |
| C. | 原混合物在反应后,被还原的硝酸与未被还原的硝酸之比为1:4 | |
| D. | 原混合物在反应后,被还原的硝酸与未被还原的硝酸之比为1:5 |
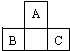 A、B、C为短周期元素,它们的位置关系如图所示,已知B、C两元素原子序数之和是A元素的原子序数的4倍,则A、B、C的元素符号分别:AO、BP、CCl.A的原子结构示意图为
A、B、C为短周期元素,它们的位置关系如图所示,已知B、C两元素原子序数之和是A元素的原子序数的4倍,则A、B、C的元素符号分别:AO、BP、CCl.A的原子结构示意图为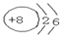 ,B在周期表中的位置第三周期第VA族,C的离子结构示意图为
,B在周期表中的位置第三周期第VA族,C的离子结构示意图为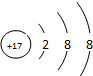 .
. (填“向左”、“向右”或“不”).
(填“向左”、“向右”或“不”).