题目内容
9.工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下(金属单质E可由滤液C制取):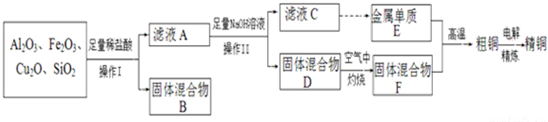
已知:Cu2O+2H+═Cu+Cu2++H2O.
请回答下列问题:
(1)滤液A中铁元素的存在形式为Fe2+(填离子符号),检验滤液A中存在该离子的方法是取少量滤液A于试管中,滴加少量酸性高锰酸钾溶液,若溶液褪色,说明该溶液中存在Fe2+.
(2)在空气中灼烧固体混合物D时,所用到的主要仪器有三脚架、坩埚钳、坩埚、玻璃棒外,还需要酒精灯、泥三角.
(3)利用电解法进行粗铜精炼时,下列叙述正确的是ac(填字母序号).
a.粗铜接电源正极,发生氧化反应
b.所得粗铜只有铜能发生电极反应
c.电解后电解液中Cu2+浓度减小
d.若阴极得到电子数为2NA,则阳极质量减少64g
(4)取52.5g该粗铜样品,加入足量的稀硫酸充分反应后,过滤、洗涤、干燥、称量,所得滤渣质量为33.6g,则粗铜中铜的质量分数为64%.
分析 Cu2O与盐酸反应生成Cu和Cu2+,SiO2与盐酸不反应,Fe2O3与盐酸反应生成Fe3+,与Cu反应生成Fe2+,固体B为SiO2和Cu,滤液A中含有Cu2+、Fe2+、Al3+,加入足量的NaOH溶液,滤液C中含有AlO2-,金属E为Al,固体D为Cu(OH)2和Fe(OH)3的混合物,在空气中灼烧,F为CuO和Fe2O3的混合物,粗铜为Cu、Al和Fe的混合物,经过电解可得纯铜,以此解答该题.
解答 解:Cu2O与盐酸反应生成Cu和Cu2+,SiO2与盐酸不反应,Fe2O3与盐酸反应生成Fe3+,与Cu反应生成Fe2+,固体B为SiO2和Cu,滤液A中含有Cu2+、Fe2+、Al3+,加入足量的NaOH溶液,滤液C中含有AlO2-,金属E为Al,固体D为Cu(OH)2和Fe(OH)3的混合物,在空气中灼烧,F为CuO和Fe2O3的混合物,粗铜为Cu、Al和Fe的混合物,经过电解可的纯铜,
(1)Cu2O与盐酸反应生成Cu和Cu2+,Fe2O3与盐酸反应生成Fe3+,Fe2O3+6H+=2Fe3++3H2O,反应生成Fe3+,与Cu反应生成Fe2+,2Fe3++Cu=2Fe2++Cu2+,有Cu剩余,则溶液中铁离子转化为亚铁离子,所以滤液A中铁元素的存在形式为Fe2+,取少量滤液A于试管中,滴加少量酸性高锰酸钾溶液,若溶液褪色,说明该溶液中存在Fe2+,
故答案为:Fe2+;取少量滤液A于试管中,滴加少量酸性高锰酸钾溶液,若溶液褪色,说明该溶液中存在Fe2+;
(2)在空气中灼烧固体混合物D时,所用到的主要仪器有三脚架、坩埚钳、坩埚、玻璃棒外,还需要酒精灯、泥三角,
故答案为:酒精灯;泥三角;
(3)a.粗铜接电源正极,作阳极,发生氧化反应,故B错误硫酸铜溶液作电解液,SO42-向阳极移动,故a正确;
b.所得粗铜中含有铝和铁,铝和铁活泼性强于铜,所以在阳极铝和铁也发生电极反应,故b错误;
c.纯铜连接电源负极,阴极,其电极反应是Cu2++2e-═Cu,阳极上金属锌、铁会先于Cu失电子,所以电解后电解液中Cu2+浓度减小,故c正确;
d.若阴极得到电子数为2NA,阳极上金属锌、铁会先于Cu失电子,则阳极质量减少不一定是64g,故d错误,
故答案为:ac;
(4)取52.5g该粗铜样品,加入足量的稀硫酸充分反应后,铝、铁与稀硫酸反应,经过滤、洗涤、干燥、称量,所得滤渣即为纯铜,其质量为33.6g,所以粗铜中铜的质量分数为$\frac{33.6}{52.5}$×100%=64%,故答案为:64%.
点评 本题考查考查物质的制备以及分离和提纯等知识,侧重于考查学生综合运用化学知识的能力,为高考常见题型,难度中等.

| A. | 乙烯和苯都可以使溴水反应褪色 | |
| B. | 甲烷和乙烯都可以与氯气反应 | |
| C. | 乙烯可以与氢气发生加成反应,苯不能与氢气加成 | |
| D. | 液化石油气和天然气的主要成分都是甲烷 |
| A. | HCO3-,Cl-,Na+,Ba2+ | B. | AlO2-,S2-,Na+,K+ | ||
| C. | SiO32-,Cl-,K+,Na+ | D. | Ba2+,Al3+,NO3-,Cl- |
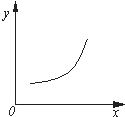 汽车尾气净化中的反应为2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.8kJ•mol-1.该反应在恒容的密闭容器中达到平衡后,若仅改变下图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
汽车尾气净化中的反应为2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.8kJ•mol-1.该反应在恒容的密闭容器中达到平衡后,若仅改变下图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )| 选项 | x | y |
| A | 压强 | 气体的平均相对分子质量 |
| B | 温度 | 平衡常数K |
| C | NO的浓度 | NO的转化率 |
| D | 温度 | 容器内混合气体的密度 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 不变 | B. | 增大 | C. | 减少 | D. | 无法确定 |
| 装置 | 实验序号 | 试管中的药品 | 现象 |
 | 实验Ⅰ | 2mL银氨溶液和数滴较浓NaOH溶液 | 有气泡产生,一段时间后,溶液逐渐变黑,试管壁附着银镜 |
| 实验Ⅱ | 2mL银氨溶液和数滴较浓氨水 | 有气泡产生,一段时间后,溶液无明显变化 |
a.Ag(NH3)2++2H2O?Ag++2NH3H2O
b.AgOH不稳定,极易分解为黑色Ag2O
(1)配制银氨溶液所需的药品是2%硝酸银,2%稀氨水.
(2)经检验,实验Ⅰ的气体中有NH3,黑色物质中有Ag2O.
①用湿润的红色石蕊试纸检验NH3产生的现象是红色石蕊试纸变蓝.
②产生Ag2O的原因是水浴加热,促使NH3•H2O分解成氨气逸出,使得可逆反应平衡右移,促进了银氨络离子向银离子的转化,银离子和氢氧根离子反应生成氢氧化银,AgOH不稳定,水浴加热分解为黑色Ag2O.
(3)该同学对产生银镜的原因提出假设:可能是NaOH还原Ag2O.实验及现象:向AgNO3溶液中加入过量NaOH溶液,出现黑色沉淀,水浴加热,未出现银镜.
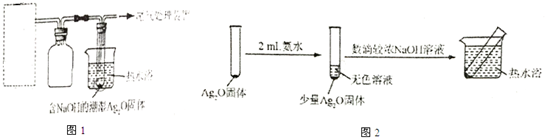
(4)重新假设:在NaOH存在下可能是NH3还原Ag2O.用如图1所示装置进行实验,现象:出现银镜.在虚线框内画出用生石灰和浓氨水制取NH3的装置简图(夹持仪器略).
(5)该同学认为在(4)的实验中会有Ag(NH3)2OH生成,由此又提出假设:在NaOH存在下,可能是Ag(NH3)2OH也参与了NH3还原Ag2O的反应.进行如图2实验:
①有部分Ag2O溶解在氨水中,该反应的化学方程式是Ag2O+4NH3•H2O=2Ag(NH3)2OH+3H2O.
②实验结果证实假设成立,依据的现象是与溶液接触的试管壁上析出银镜.
③用HNO3清洗试管壁上的Ag,该反应的化学方程式是2HNO3(浓)+Ag═AgNO3+2NO2↑+H2O.
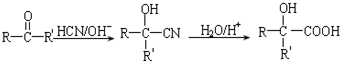
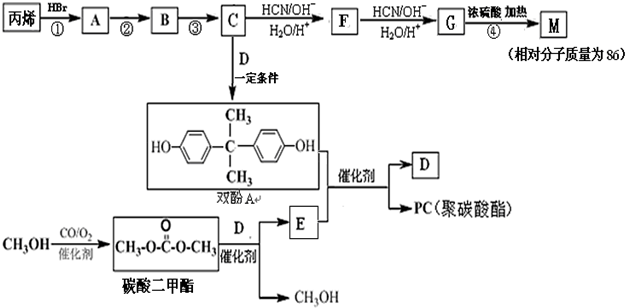
 .
. 、
、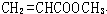 、
、 .
.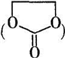 能与CH3OH发生酯交换反应生成碳酸二甲酯和另一种醇,写出该反应的化学方程式
能与CH3OH发生酯交换反应生成碳酸二甲酯和另一种醇,写出该反应的化学方程式
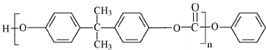 或
或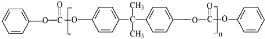 .
. (填“向左”、“向右”或“不”).
(填“向左”、“向右”或“不”).