题目内容
16.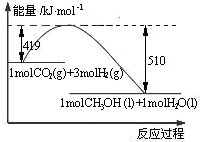 5、常温下,反应CO2(g)+3H2(g)?CH3OH(l)+H2O(l)的能量变化如图所示.反应达到平衡后,要使该反应化学平衡向右移动,其他条件不变,可采取的措施是( )
5、常温下,反应CO2(g)+3H2(g)?CH3OH(l)+H2O(l)的能量变化如图所示.反应达到平衡后,要使该反应化学平衡向右移动,其他条件不变,可采取的措施是( )| A. | 升高温度 | B. | 分离出甲醇 | ||
| C. | 缩小反应器体积 | D. | 使用合适的催化剂 |
分析 根据图象可知,反应CO2(g)+3H2(g)?CH3OH(l)+H2O(l)反应物总能量大于生成物总能量,则该反应为气体体积减小的放热反应,要使该反应化学平衡向右移动,可以采用加压降温的方法,据此分析.
解答 解:根据图象可知,反应CO2(g)+3H2(g)?CH3OH(l)+H2O(l)反应物总能量大于生成物总能量,则该反应为气体体积减小的放热反应,
A、升高温度,平衡向吸热反应即逆反应方向移动,故A错误;
B、分离出甲醇即减小生成物浓度,所以平衡向右移动,故B正确;
C、缩小反应器体积,即加压,平衡向气体体积减小的正反应方向移动,故C正确;
D、催化剂只改变反应速率不改变平衡移动,故D错误;
故选BC.
点评 本题考查了影响平衡移动的因素,根据该反应为气体体积减小的放热反应结合移动原理分析,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.实验室配制450mL1.0mol?L-1 NaOH溶液,下列有关说法正确的是( )
| A. | 应用托盘天平称取20g NaOH固体 | |
| B. | 配制过程中所用玻璃棒的作用是搅拌和引流 | |
| C. | NaOH固体在烧杯中称量时间过长,所配NaOH溶液的浓度偏大 | |
| D. | 定容摇匀后,发现液面下降,继续加水至刻度线,对所配NaOH溶液的浓度无影响 |
4.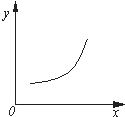 汽车尾气净化中的反应为2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.8kJ•mol-1.该反应在恒容的密闭容器中达到平衡后,若仅改变下图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
汽车尾气净化中的反应为2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.8kJ•mol-1.该反应在恒容的密闭容器中达到平衡后,若仅改变下图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
 汽车尾气净化中的反应为2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.8kJ•mol-1.该反应在恒容的密闭容器中达到平衡后,若仅改变下图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
汽车尾气净化中的反应为2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.8kJ•mol-1.该反应在恒容的密闭容器中达到平衡后,若仅改变下图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )| 选项 | x | y |
| A | 压强 | 气体的平均相对分子质量 |
| B | 温度 | 平衡常数K |
| C | NO的浓度 | NO的转化率 |
| D | 温度 | 容器内混合气体的密度 |
| A. | A | B. | B | C. | C | D. | D |
11.下列实验设计及其对应的离子方程式均正确的是( )
| A. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+═Cu2++2Fe2+ | |
| B. | Na2O2与H2O反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| C. | 向NaAlO2溶液中通入过量CO2:2 AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
1.恒温时,在一容积固定的容器中充入2mol的NO2,反应2NO2(g)?N2O4(g) 达到平衡时,向容器入通入2mol的NO2,重新达到平衡后,与第一次平衡时相比,NO2的转化率( )
| A. | 不变 | B. | 增大 | C. | 减少 | D. | 无法确定 |
8.有关硅元素的下列叙述中正确的是( )
| A. | 硅与任何酸都不反应 | |
| B. | 硅是构成矿物岩石的主要原料,其化合态硅几乎全部是硅石(成份为SiO2)和硅酸盐 | |
| C. | 硅的性质很稳定,能以游离态存在于自然界 | |
| D. | 常温时硅不与任何物质反应 |
6.以下除杂方案不正确的是( )
| A. | Cl2中混有HCl,可依次通入盛有饱和食盐水、浓H2SO4的洗气瓶 | |
| B. | NH4Cl 溶液中混有Fe3+,可加入NaOH溶液后过滤 | |
| C. | CO中混有CO2,可依次通入盛NaOH 溶液、浓 H2SO4的洗气瓶 | |
| D. | Na2CO3固体中混有NaHCO3,可用灼烧的方法除尽 |