题目内容
13.下列配合物的配位数不是6的是( )| A. | K2[Co(NCS)3]Cl | B. | Na2[SiF2Cl2Br2] | C. | Na3[AlF6] | D. | [Cr(NH3)4(H2O)2]Cl3 |
分析 首先根据配合物的化学式确定配离子和外界离子,根据配离子确定配体的数目,即配位数.
解答 解:A.K2[Co(NCS)3]Cl中配体为NCS-,配合物的配位数为3,故A选;
B.Na2[SiF2Cl2Br2]中配体为F-、Cl-、Br-,配合物的配位数为6,故B不选;
C.Na3[AlF6]中配体为F-,配合物的配位数为6,故C不选;
D.[Cr(NH3)4(H2O)2]Cl3中配体为NH3和H2O,配合物的配位数为6,故D不选.
故选A.
点评 本题考查配合物的成键情况,题目难度不大,注意配体、中心离子、外界离子以及配位数的判断,把握相关概念,不要混淆.

练习册系列答案
相关题目
4.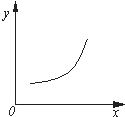 汽车尾气净化中的反应为2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.8kJ•mol-1.该反应在恒容的密闭容器中达到平衡后,若仅改变下图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
汽车尾气净化中的反应为2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.8kJ•mol-1.该反应在恒容的密闭容器中达到平衡后,若仅改变下图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
 汽车尾气净化中的反应为2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.8kJ•mol-1.该反应在恒容的密闭容器中达到平衡后,若仅改变下图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
汽车尾气净化中的反应为2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.8kJ•mol-1.该反应在恒容的密闭容器中达到平衡后,若仅改变下图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )| 选项 | x | y |
| A | 压强 | 气体的平均相对分子质量 |
| B | 温度 | 平衡常数K |
| C | NO的浓度 | NO的转化率 |
| D | 温度 | 容器内混合气体的密度 |
| A. | A | B. | B | C. | C | D. | D |
1.恒温时,在一容积固定的容器中充入2mol的NO2,反应2NO2(g)?N2O4(g) 达到平衡时,向容器入通入2mol的NO2,重新达到平衡后,与第一次平衡时相比,NO2的转化率( )
| A. | 不变 | B. | 增大 | C. | 减少 | D. | 无法确定 |
8.有关硅元素的下列叙述中正确的是( )
| A. | 硅与任何酸都不反应 | |
| B. | 硅是构成矿物岩石的主要原料,其化合态硅几乎全部是硅石(成份为SiO2)和硅酸盐 | |
| C. | 硅的性质很稳定,能以游离态存在于自然界 | |
| D. | 常温时硅不与任何物质反应 |
18.有文献记载:在强碱条件下,加热银氨溶液可能析出银镜.某同学进行如表验证和对比实验.
该同学欲分析实验Ⅰ和实验Ⅱ的差异,查阅资料:
a.Ag(NH3)2++2H2O?Ag++2NH3H2O
b.AgOH不稳定,极易分解为黑色Ag2O
(1)配制银氨溶液所需的药品是2%硝酸银,2%稀氨水.
(2)经检验,实验Ⅰ的气体中有NH3,黑色物质中有Ag2O.
①用湿润的红色石蕊试纸检验NH3产生的现象是红色石蕊试纸变蓝.
②产生Ag2O的原因是水浴加热,促使NH3•H2O分解成氨气逸出,使得可逆反应平衡右移,促进了银氨络离子向银离子的转化,银离子和氢氧根离子反应生成氢氧化银,AgOH不稳定,水浴加热分解为黑色Ag2O.
(3)该同学对产生银镜的原因提出假设:可能是NaOH还原Ag2O.实验及现象:向AgNO3溶液中加入过量NaOH溶液,出现黑色沉淀,水浴加热,未出现银镜.
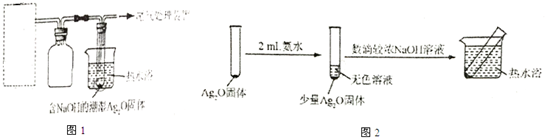
(4)重新假设:在NaOH存在下可能是NH3还原Ag2O.用如图1所示装置进行实验,现象:出现银镜.在虚线框内画出用生石灰和浓氨水制取NH3的装置简图(夹持仪器略).
(5)该同学认为在(4)的实验中会有Ag(NH3)2OH生成,由此又提出假设:在NaOH存在下,可能是Ag(NH3)2OH也参与了NH3还原Ag2O的反应.进行如图2实验:
①有部分Ag2O溶解在氨水中,该反应的化学方程式是Ag2O+4NH3•H2O=2Ag(NH3)2OH+3H2O.
②实验结果证实假设成立,依据的现象是与溶液接触的试管壁上析出银镜.
③用HNO3清洗试管壁上的Ag,该反应的化学方程式是2HNO3(浓)+Ag═AgNO3+2NO2↑+H2O.
| 装置 | 实验序号 | 试管中的药品 | 现象 |
 | 实验Ⅰ | 2mL银氨溶液和数滴较浓NaOH溶液 | 有气泡产生,一段时间后,溶液逐渐变黑,试管壁附着银镜 |
| 实验Ⅱ | 2mL银氨溶液和数滴较浓氨水 | 有气泡产生,一段时间后,溶液无明显变化 |
a.Ag(NH3)2++2H2O?Ag++2NH3H2O
b.AgOH不稳定,极易分解为黑色Ag2O
(1)配制银氨溶液所需的药品是2%硝酸银,2%稀氨水.
(2)经检验,实验Ⅰ的气体中有NH3,黑色物质中有Ag2O.
①用湿润的红色石蕊试纸检验NH3产生的现象是红色石蕊试纸变蓝.
②产生Ag2O的原因是水浴加热,促使NH3•H2O分解成氨气逸出,使得可逆反应平衡右移,促进了银氨络离子向银离子的转化,银离子和氢氧根离子反应生成氢氧化银,AgOH不稳定,水浴加热分解为黑色Ag2O.
(3)该同学对产生银镜的原因提出假设:可能是NaOH还原Ag2O.实验及现象:向AgNO3溶液中加入过量NaOH溶液,出现黑色沉淀,水浴加热,未出现银镜.
(4)重新假设:在NaOH存在下可能是NH3还原Ag2O.用如图1所示装置进行实验,现象:出现银镜.在虚线框内画出用生石灰和浓氨水制取NH3的装置简图(夹持仪器略).
(5)该同学认为在(4)的实验中会有Ag(NH3)2OH生成,由此又提出假设:在NaOH存在下,可能是Ag(NH3)2OH也参与了NH3还原Ag2O的反应.进行如图2实验:
①有部分Ag2O溶解在氨水中,该反应的化学方程式是Ag2O+4NH3•H2O=2Ag(NH3)2OH+3H2O.
②实验结果证实假设成立,依据的现象是与溶液接触的试管壁上析出银镜.
③用HNO3清洗试管壁上的Ag,该反应的化学方程式是2HNO3(浓)+Ag═AgNO3+2NO2↑+H2O.

2.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,下列反应可制取K2FeO4:2Fe(OH)3+3Cl2+10KOH═2K2FeO4+6KCl+8H2O.对于该反应,下列说法正确的是( )
| A. | 该反应是置换反应 | |
| B. | 该反应只有K2FeO4为氧化产物 | |
| C. | 3mol氯气参与反应转移电子数为6个 | |
| D. | 该反应条件下K2FeO4的氧化性大于Cl2 |
3.下列说法正确的是( )
| A. | SiO2是酸性氧化物,能与NaOH溶液反应 | |
| B. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| C. | 硫化亚铁溶于稀硝酸中的离子方程式为:FeS+2H+═Fe2++H2S↑ | |
| D. | pH=1的溶液中:Fe2+、NO3-、SO42-、Na+能够大量共存 |
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示 (已知硝酸只被还原为NO气体).
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示 (已知硝酸只被还原为NO气体).