题目内容
14. X、Y、Z、W、R是原子序数依次增大的前四周期元素.X的单质在Y2中燃烧可生成XY和XY2两种气体;Z的单质在Y2中燃烧的产物ZY2可使品红溶液褪色;W的单质是黄绿色的有毒气体;R3+离子的3d轨道半充满.请回答下列问题:
X、Y、Z、W、R是原子序数依次增大的前四周期元素.X的单质在Y2中燃烧可生成XY和XY2两种气体;Z的单质在Y2中燃烧的产物ZY2可使品红溶液褪色;W的单质是黄绿色的有毒气体;R3+离子的3d轨道半充满.请回答下列问题:(1)X元素在元素周期表中的位置第二周期ⅣA族,R基态原子的电子排布式为1s22s22p63s23p63d64s2;Y、Z、R三种元素中,电负性最大的是O.(用元素符号表示)
(2)XY2的中心原子杂化方式为sp,其分子的空间构型直线型.
(3)金属R单质的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.体心立方晶胞和面心立方晶胞中实际占有的R原子的个数之比为1:2.
(4)ZY2气体通入足量的含R3+和Ba2+的混合溶液中,生成白色沉淀,该反应的离子方程式为2Fe3++SO2+Ba2++2H2O=BaSO4↓+2Fe2++4H+.
分析 X、Y、Z、W、R是原子序数依次增大的前四周期元素,Z的单质在Y2中燃烧的产物ZY2可使品红溶液褪色,则Y是O元素、Z是S元素、ZY2为SO2;X的单质在Y2中燃烧可生成XY和XY2两种气体,且X原子序数小于Y,则X是C元素,生成的两种气体为CO、CO2;W的单质是黄绿色的有毒气体,则W是Cl元素;R3+离子的3d轨道半充满,R原子外围电子排布为3d64s2,核外有26个电子,故R为Fe元素.
(1)X为C元素,主族元素周期数=电子层数、主族族序数=最外层电子数;R为26号元素Fe,原子核外电子数为26,根据构造原理书写R基态原子核外电子排布式;元素的非金属性越强,其电负性越大;
(2)计算CO2分子中C原子价层电子对数确定C原子杂化方式,结合价层电子对数、孤电子对数确定空间构型;
(3)利用均摊法计算晶胞中Fe原子个数之比;
(4)SO2气体通入足量的含Fe3+和Ba2+的混合溶液中,发生氧化还原反应生成硫酸根离子、亚铁离子,硫酸根离子和钡离子反应生成硫酸钡白色沉淀.
解答 解:X、Y、Z、W、R是原子序数依次增大的前四周期元素,Z的单质在Y2中燃烧的产物ZY2可使品红溶液褪色,则Y是O元素、Z是S元素、ZY2为SO2;X的单质在Y2中燃烧可生成XY和XY2两种气体,且X原子序数小于Y,则X是C元素,生成的两种气体为CO、CO2;W的单质是黄绿色的有毒气体,则W是Cl元素;R3+离子的3d轨道半充满,R原子外围电子排布为3d64s2,核外有26个电子,故R为Fe元素.
(1)X为C元素,处于周期表中第二周期ⅣA族,R为26号元素Fe,原子核外电子数为26,基态原子核外电子排布式为1s22s22p63s23p63d64s2,O、S、Fe三种元素中,元素的非金属性越强,其电负性越大,所以这三种元素电负性大小顺序是O>S>Fe,则电负性最大的是O元素,
故答案为:第二周期ⅣA族;1s22s22p63s23p63d64s2;O;
(2)CO2分子中中心原子价层电子对个数是2+$\frac{4-2×2}{2}$=2,不含孤电子对,所以C原子杂化方式为sp,分子空间结构为直线型,答案为:sp;直线形;
(3)体心立方晶胞中Fe原子个数=1+8×$\frac{1}{8}$=2,面心立方中Fe原子个数=6×$\frac{1}{2}$+8×$\frac{1}{8}$=4,体心立方晶胞和面心立方晶胞中实际占有的R原子的个数之比=2:4=1:2,故答案为:1:2;
(4)SO2气体通入足量的含Fe3+和Ba2+的混合溶液中发生氧化还原反应生成硫酸根离子、亚铁离子,硫酸根离子和钡离子反应生成硫酸钡白色沉淀,离子方程式为:2Fe3++SO2+Ba2++2H2O=BaSO4↓+2Fe2++4H+,
故答案为:2Fe3++SO2+Ba2++2H2O=BaSO4↓+2Fe2++4H+.
点评 本题考查位置结构性质相互关系及应用,推断元素是解题关键,涉及核外电子排布、杂化方式与空间构型判断、晶胞计算、氧化还原反应等知识点,题目难度中等.

| A. | 该装置能将电能转化为化学能 | B. | 实验过程中铜片逐渐溶解 | ||
| C. | 铁片上会析出红色的铜 | D. | 电子由铁片通过导线流向铜片 |
Ⅰ.将光亮铜丝插入浓硫酸,加热;
Ⅱ.待产生黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
(1)甲同学认为根据所学知识:已知硫化铜(CuS)、硫化亚铜(Cu2S)、粉末和氧化铜粉末相似且都不溶于水,在空气中煅烧硫化铜和硫化亚铜都转化二种氧化物,设计一个不用任何化学试剂就能鉴别氧化铜、硫化铜、硫化亚铜三种粉末的简便实验方案,请帮助甲同学将方案填写于下表中,实验提供天平及其他必要的设备.
| 实验步骤 | 实验现象 | 结论及有关化学方程式 |
| A.分别称取相同质量的样品,在空气中燃烧; B.分别称量硫化铜和硫化亚铜灼烧后剩余物质的质量 | A.有一种固体无变化,两种固体产生刺激性气味气体 B.有一种样品质量减轻,一种样品质量不变 | A.固体无变化的是氧化铜,产生刺激性气味气体的是硫化铜和硫化亚铜,在空气中煅烧中反应的化学方程式分别为2CuS+3O2 $\frac{\underline{\;\;△\;\;}}{\;}$2CuO+2SO2; Cu2S+2O2 $\frac{\underline{\;\;△\;\;}}{\;}$2CuO+SO2 B.质量减轻的是硫化铜,质量不变的是硫化亚铜 |
①将CuO放入稀硫酸中,一段时间后,再滴加K4[Fe(CN)6]溶液,产生红褐色沉淀.
②将黑色沉淀放入稀硫酸中,一段时间后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀.
由该检验过程所得结论是黑色沉淀中不含有CuO.
(3)丙同学再次假设,黑色沉淀是铜的硫化物.实验如下:
| 实验装置 | 现象 |
 | 1.A试管中黑色沉淀逐渐溶解 2.A试管内上方出现红棕色气体 3.B试管中出现白色沉淀 |
②能确认黑色沉淀中含有S元素的现象是B试管中出现白色沉淀,相应的离子方程式是NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+.
③为确认黑色沉淀是“铜的硫化物”,还需进行的实验操作是取冷却后A装置试管中的溶液,滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+,说明黑色沉淀是铜的硫化物.
以上实验说明,黑色沉淀中存在铜的硫化物.进一步实验后证明黑色沉淀是CuS与Cu2S的混合物.将黑色沉淀放入浓硫酸中加热一段时间后,沉淀溶解,其中CuS溶解的化学方程式是CuS+4H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+4SO2↑+4H2O.
(4)丁同学通过实验确认,固体只含有硫化铜和硫化亚铜,他通过以下实验求硫化亚铜的百分含量:取2g Cu2S和CuS的混合物在酸性溶液中用400mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350mL 0.1mol/L(NH4)2Fe(SO4)2溶液完全反应.
则混合物中Cu2S的质量分数为40%.
| A. | 乙烯和苯都可以使溴水反应褪色 | |
| B. | 甲烷和乙烯都可以与氯气反应 | |
| C. | 乙烯可以与氢气发生加成反应,苯不能与氢气加成 | |
| D. | 液化石油气和天然气的主要成分都是甲烷 |
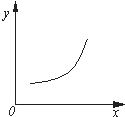 汽车尾气净化中的反应为2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.8kJ•mol-1.该反应在恒容的密闭容器中达到平衡后,若仅改变下图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
汽车尾气净化中的反应为2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.8kJ•mol-1.该反应在恒容的密闭容器中达到平衡后,若仅改变下图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )| 选项 | x | y |
| A | 压强 | 气体的平均相对分子质量 |
| B | 温度 | 平衡常数K |
| C | NO的浓度 | NO的转化率 |
| D | 温度 | 容器内混合气体的密度 |
| A. | A | B. | B | C. | C | D. | D |



 实验室用MnO2、KOH及KClO3为原料制取高锰酸钾的实验流程如下:
实验室用MnO2、KOH及KClO3为原料制取高锰酸钾的实验流程如下:

 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示 (已知硝酸只被还原为NO气体).
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示 (已知硝酸只被还原为NO气体).