题目内容
17.可逆反应4A(g)+5B(g)?4C(g)+6D(g),取4molA和5molB置于容积为5L的容器中,20s后,测得容器内A的浓度为0.4mol/L.(1)此时B、C的浓度是0.5mol/L、0.4mol/L;
(2)若以物质D来表示这段时间的反应速率应为0.03mol/(L•s).
分析 (1)4A(g)+5B(g)?4C(g)+6D(g),
起始:4mol 5mol 0 0
反应:2mol 2.5mol 2mol 3mol
20s:2mol 2.5mol 2mol 3mol
即可计算B、C的浓度;
(2)根据v=$\frac{△c}{△t}$,计算v(D).
解答 解:(1)20s后,测得容器内A的浓度为0.4mol/L,容器内剩余A:0.4mol/L×5L=2mol,则参加反应的A为4mol-2mol=2mol,根据
4A(g)+5B(g)?4C(g)+6D(g),
起始:4mol 5mol 0 0
反应:2mol 2.5mol 2mol 3mol
20s:2mol 2.5mol 2mol 3mol
则此时C(B)=$\frac{2.5mol}{5L}$=0.5mol/L; C(C)=$\frac{2mol}{5L}$=0.4mol/L;
故答案为:0.5mol/L;0.4mol/L;
(2)以物质D来表示这段时间的反应速率应为v(D)=$\frac{△c}{△t}$=$\frac{3mol}{5L•20s}$=0.03mol/(L•s);
故答案为:0.03mol/(L•s).
点评 主要考查化学反应速率计算,难度不大,注意基础知识掌握,熟记反应速率公式

练习册系列答案
相关题目
7.下列说法错误的是( )
| A. | 作半导体材料的元素大多数位于周期表中金属元素和非金属元素的交界处 | |
| B. | 农药中常含有的元素通常在元素周期表的右上方区域内 | |
| C. | 构成催化剂的元素通常在元素周期表的左下方区域内 | |
| D. | 在周期表过渡元素中寻找作耐高温和耐腐蚀的合金材料的元素 |
8.与F-具有相同的质子数和电子数的微粒是( )
| A. | Cl- | B. | OH- | C. | NH${\;}_{4}^{+}$ | D. | NH3 |
12.在一定条件下,某密闭容器中发生反应:N2(g)+3H2(g)═2NH3(g).反应物N2的浓度10s内从2mol/L降为1mol/L,在这段时间内用N2浓度的变化表示的反应速率为( )
| A. | 0.05 mol/(L•s) | B. | 0.1 mol/(L•s) | C. | 0.15 mol/(L•s) | D. | 0.2 mol/(L•s) |
2.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 62gNa2O溶于水后所得溶液中含有的O2-数为NA | |
| B. | 1mol氯气和足量NaOH溶液反应转移电子数为2NA | |
| C. | 在含Al3+总数为NA的AlCl3溶液中,Cl-总数大于3NA | |
| D. | 0.1 mol FeCl3滴入沸水形成的 胶体粒子的 数目为0.1NA |
9.以2-溴丙烷为原料制取1,2-丙二醇,需要经过的反应是( )
| A. | 消去-加成-取代 | B. | 取代-消去-加成 | C. | 消去-取代-加成 | D. | 加成-消去-取代 |
6.下列有关电解质溶液中离子浓度关系的叙述中正确的是( )
| A. | 0.1mol•L-1的(NH4)2Fe(SO4)2溶液中,c(Fe2+)+c(NH4+)+c(H+)=c(SO42-)+c(OH-) | |
| B. | 等体积等物质的量浓度的Na2CO3和NaHCO3溶液混合:2c(CO32-)+2c(HCO3-)+2c(H2CO3)=3c(Na+) | |
| C. | 0.2mol•L-1的CH3COOH溶液与0.1mol•L-1的NaOH溶液等体积混合:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-) | |
| D. | PH相同的CH3COONa溶液、NaHCO3溶液、NaOH溶液:c(NaHCO3)>c(CH3COONa)>c(NaOH) |
16.A、B、C、D、E、F六种短周期元素的原子序数依次增大.A、C、F位于三个不同的周期,一定条件下可发生反应:A的单质+C的单质→气态化合物甲、A的单质+F的单质→气态化合物乙,且甲和乙相遇生成固体丙时有白烟产生;D元素原子最外层电子数是电子层数的3倍,B、D两元素原子的核外电子数之和等于C元素原子核内质子数的2倍;元素E是所在周期中简单离子半径最小的元素.按要求回答下列问题:
(1)请在下列表格中用实线画出短周期主族元素的边界.
(2)指出元素F在元素周期表中的位置第三周期第ⅦA族;
(3)化合物甲的结构式为 ,物质丙的电子式为
,物质丙的电子式为 ;
;
(4)元素B和D组成的化合物丁是绿色植物进行光合作用的主要原料之一,用电子式表示化合物丁的形成过程: ;
;
(5)元素D的简单离子与元素E的简单离子的半径大小关系是O2->Al3+(用离子符号表示);
(6)B、C、F的最高价氧化物对应水化物的酸性有强到弱的顺序是HClO4>HNO3>H2CO3(用化学式表示);
(7)写出元素E的最高价氧化物与元素C的最高价氧化物对应水化物反应的离子方程式Al2O3+6H+=2Al3++3H2O.
(1)请在下列表格中用实线画出短周期主族元素的边界.
(3)化合物甲的结构式为
 ,物质丙的电子式为
,物质丙的电子式为 ;
;(4)元素B和D组成的化合物丁是绿色植物进行光合作用的主要原料之一,用电子式表示化合物丁的形成过程:
 ;
;(5)元素D的简单离子与元素E的简单离子的半径大小关系是O2->Al3+(用离子符号表示);
(6)B、C、F的最高价氧化物对应水化物的酸性有强到弱的顺序是HClO4>HNO3>H2CO3(用化学式表示);
(7)写出元素E的最高价氧化物与元素C的最高价氧化物对应水化物反应的离子方程式Al2O3+6H+=2Al3++3H2O.
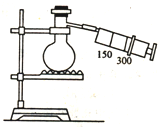 如图所示(图中部分仪器未画出)有一容积为300mL的注射器,与蒸馏烧瓶(500mL)相连接,烧瓶中有0.384g Cu片,现向烧瓶中加入18mL 2.5mol•L-1的稀HNO3溶液,并立即用锡箔包住橡皮塞封住瓶口.(气体体积视为标准状况下的)试回答:
如图所示(图中部分仪器未画出)有一容积为300mL的注射器,与蒸馏烧瓶(500mL)相连接,烧瓶中有0.384g Cu片,现向烧瓶中加入18mL 2.5mol•L-1的稀HNO3溶液,并立即用锡箔包住橡皮塞封住瓶口.(气体体积视为标准状况下的)试回答: