题目内容
20.常温下,下列说法正确的是( )| A. | 往CH3COOH溶液中加水,c(OHˉ)和c(H+)均增大 | |
| B. | 物质的量浓度均为0.1mol•Lˉ1的CH3COOH溶液和NaOH溶液等体积混合,c(Na+)<c(CH3COOˉ) | |
| C. | 某浓度的氯化铵溶液中存在c(NH4+)>c(Clˉ)>c(H+)>c(OHˉ) | |
| D. | 在pH=4的氯化铵溶液中c(H+)+c(NH4+)=c(Clˉ)+c(OHˉ) |
分析 A.醋酸溶液稀释后,溶液中氢离子浓度减小;
B.二者反应后生成醋酸钠,醋酸根离子部分水解,则c(Na+)>c(CH3COO-);
C.氯化铵溶液中,铵根离子部分水解,溶液显示酸性,则c(Cl-)>c(NH4+)、c(H+)>c(OH-);
D.根据溶液中的电荷守恒判断.
解答 解:A.往CH3COOH溶液中加水,醋酸的电离程度增大,但是溶液中氢离子浓度减小,由于水的离子积不变,则氢氧根离子浓度增大,故A错误;
B.物质的量浓度均为0.1mol•L-1的CH3COOH溶液和NaOH溶液等体积混合,恰好反应生成醋酸钠,由于醋酸根离子部分水解,则:c(Na+)>c(CH3COO-),故B错误;
C.在氯化铵溶液中,铵根离子部分水解,溶液呈酸性,则:c(Cl-)>c(NH4+)、c(H+)>c(OH-),溶液中正确的离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故C错误;
D.pH=4的氯化铵溶液中,根据电荷守恒可得:c(H+)+c(NH4+)=c(Cl-)+c(OH-),故D正确;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成及盐的水解原理为解答关键,注意掌握电荷守恒、物料守恒的含义及在判断离子浓度大小中的应用方法.

练习册系列答案
相关题目
10.下列说法中,正确的是( )
| A. | 要检验某溴乙烷中的溴元素,可以加入NaOH溶液共热,冷却后滴入AgNO3溶液,观察有无浅黄色沉淀生成 | |
| B. | 实验室制取乙烯时,常伴有刺激性气味的气体产生,说明部分乙醇被氧化为乙醛 | |
| C. | 凡是能发生银镜反应的物质一定是醛或羧酸中的甲酸 | |
| D. | 向苯酚钠溶液中通入过量的二氧化碳气体时,生成物不可能是碳酸钠 |
11.设NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,11.2LNO与11.2LO2混合后所含分子数为0.75NA | |
| B. | 0.1molNa2O2晶体中含有0.3NA个离子 | |
| C. | pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| D. | 标准状况下,22.4L甲醇中含有的氧原子数为1.0NA |
8.与F-具有相同的质子数和电子数的微粒是( )
| A. | Cl- | B. | OH- | C. | NH${\;}_{4}^{+}$ | D. | NH3 |
15.现有部分短周期元素的性质与原子(或分子)结构如下表:
(1)画出元素T原子结构示意图 ;
;
(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示),下列表述中能证明这一事实的是cd(填序号);
a.Y单质的熔点比Z单质低 b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈 d.Y最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的化学式为Na2O2.
(4)元素T和氢元素以原子个数比1:1形成的化合物的电子式为 ,元素Z最高价氧化物的水化物与元素Y的最高价氧化物的水化物的溶液相互反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
,元素Z最高价氧化物的水化物与元素Y的最高价氧化物的水化物的溶液相互反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下,单质为双原子分子,分子中含有3对共用电子对,其简单氢化物的水溶液显碱性 |
| Y | M层比K层少1个电子 |
| Z | 第3周期元素的简单离子中半径最小的,其氧化物呈两性 |
 ;
;(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示),下列表述中能证明这一事实的是cd(填序号);
a.Y单质的熔点比Z单质低 b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈 d.Y最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的化学式为Na2O2.
(4)元素T和氢元素以原子个数比1:1形成的化合物的电子式为
 ,元素Z最高价氧化物的水化物与元素Y的最高价氧化物的水化物的溶液相互反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
,元素Z最高价氧化物的水化物与元素Y的最高价氧化物的水化物的溶液相互反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
12.在一定条件下,某密闭容器中发生反应:N2(g)+3H2(g)═2NH3(g).反应物N2的浓度10s内从2mol/L降为1mol/L,在这段时间内用N2浓度的变化表示的反应速率为( )
| A. | 0.05 mol/(L•s) | B. | 0.1 mol/(L•s) | C. | 0.15 mol/(L•s) | D. | 0.2 mol/(L•s) |
9.以2-溴丙烷为原料制取1,2-丙二醇,需要经过的反应是( )
| A. | 消去-加成-取代 | B. | 取代-消去-加成 | C. | 消去-取代-加成 | D. | 加成-消去-取代 |
10.对常温下pH=3和pH=5的两种CH3COOH溶液,下列叙述不正确的是( )
| A. | 两溶液中都存在:c(H+)=c(CH3COO-)+c(OH-) | |
| B. | 两溶液中由水电离出的c(H+)分别是1.0×10-11mol/L和1.0×10-9mol/L | |
| C. | 两溶液中分别加入蒸馏水稀释100倍时,溶液的c(H+)之比大于100:1 | |
| D. | 等体积的两溶液分别与相同浓度的NaOH溶液完全发生中和反应时,所需的NaOH溶液体积比为1:100 |
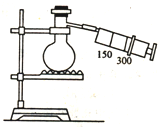 如图所示(图中部分仪器未画出)有一容积为300mL的注射器,与蒸馏烧瓶(500mL)相连接,烧瓶中有0.384g Cu片,现向烧瓶中加入18mL 2.5mol•L-1的稀HNO3溶液,并立即用锡箔包住橡皮塞封住瓶口.(气体体积视为标准状况下的)试回答:
如图所示(图中部分仪器未画出)有一容积为300mL的注射器,与蒸馏烧瓶(500mL)相连接,烧瓶中有0.384g Cu片,现向烧瓶中加入18mL 2.5mol•L-1的稀HNO3溶液,并立即用锡箔包住橡皮塞封住瓶口.(气体体积视为标准状况下的)试回答: