题目内容
3.某有机物由C、H、O三种元素组成,其相对分子质量为76,0.05mol该有机物完全燃烧的产物用碱石灰完全吸收,碱石灰增重6.2g,相同质量的该有机物完全燃烧的产物通过足量Na2O2 ,它只增重3g.(1)该有机物的分子式;
(2)若该有机物既能与乙醇、又能与乙酸发生酯化反应,写出该有机物的结构简式.
分析 相对分子质量为76,0.05mol该有机物的质量为76g/mol×0.05mol=3.8g,完全燃烧的产物用碱石灰完全吸收,碱石灰增重6.2g,即生成的二氧化碳和水的质量共为6.2g,有机物在足量氧气中燃烧生成CO2和H2O,与Na2O2发生反应:2Na2O2+CO2=2Na2CO3+O2↑,2Na2O2+2H2O=4NaOH+O2↑,对生成物变式:Na2CO3~Na2O2•CO,2NaOH~Na2O2•H2,固体增加的质量相当于CO和H2的质量,
相同质量的该有机物完全燃烧的产物通过足量Na2O2 ,它只增重3g,应为CO和H原子的质量,以此解答该题.
解答 解:设有机物的分子式为CxHyOz,
其相对分子质量为76,则12x+y+16y=76…①;
0.05mol该有机物完全燃烧的产物用碱石灰完全吸收,碱石灰增重6.2g,应为二氧化碳和水的质量,则0.05x×44+$\frac{1}{2}$×0.05y×18=6.2…②;
相同质量的该有机物完全燃烧的产物通过足量Na2O2 ,它只增重3g,
有机物在足量氧气中燃烧生成CO2和H2O,与Na2O2发生反应:2Na2O2+CO2=2Na2CO3+O2↑,2Na2O2+2H2O=4NaOH+O2↑,对生成物变式:Na2CO3~Na2O2•CO,2NaOH~Na2O2•H2,固体增加的质量相当于CO和H2的质量,
则0.05x×28+0.05y=3…③,
联式①②③可得x=2,y=4,z=3,
则分子式为C2H4O3,
若该有机物既能与乙醇、又能与乙酸发生酯化反应,说明含有羟基和羧基,结构简式为HOCH2COOH,
答:(1)该有机物的分子式为C2H4O3;
(2)该有机物的结构简式为HOCH2COOH.
点评 本题考查了分子式和结构简式的确定等知识点,为高频考点,侧重于学生的分析、计算能力的考查,明确有机物中官能团的性质是解本题的关键,难度不大.

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案| A. | 在1 mol NaHSO4晶体中,含阳离子数为2NA | |
| B. | 1 mol C4H10分子中共价键总数为13NA | |
| C. | 0.5 mol•L-1 Ba(NO3)2溶液中,NO${\;}_{3}^{-}$的数目为NA | |
| D. | 任何条件下,20 L N2含有的分子数都不可能为NA |
| A. | 标准状况下,11.2LNO与11.2LO2混合后所含分子数为0.75NA | |
| B. | 0.1molNa2O2晶体中含有0.3NA个离子 | |
| C. | pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| D. | 标准状况下,22.4L甲醇中含有的氧原子数为1.0NA |
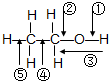 乙醇分子结构中,各种化学键如图所示.乙醇在各种反应中断裂键的说明不正确的是( )
乙醇分子结构中,各种化学键如图所示.乙醇在各种反应中断裂键的说明不正确的是( )| A. | 在Cu催化下和O2反应时断裂①,③键 | B. | 和金属钠反应时断裂键① | ||
| C. | 完全燃烧时全部断裂 | D. | 与浓H2SO4共热170℃时断裂键②④ |
| A. | Cl- | B. | OH- | C. | NH${\;}_{4}^{+}$ | D. | NH3 |
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下,单质为双原子分子,分子中含有3对共用电子对,其简单氢化物的水溶液显碱性 |
| Y | M层比K层少1个电子 |
| Z | 第3周期元素的简单离子中半径最小的,其氧化物呈两性 |
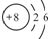 ;
;(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示),下列表述中能证明这一事实的是cd(填序号);
a.Y单质的熔点比Z单质低 b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈 d.Y最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的化学式为Na2O2.
(4)元素T和氢元素以原子个数比1:1形成的化合物的电子式为
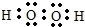 ,元素Z最高价氧化物的水化物与元素Y的最高价氧化物的水化物的溶液相互反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
,元素Z最高价氧化物的水化物与元素Y的最高价氧化物的水化物的溶液相互反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O. | A. | 0.05 mol/(L•s) | B. | 0.1 mol/(L•s) | C. | 0.15 mol/(L•s) | D. | 0.2 mol/(L•s) |
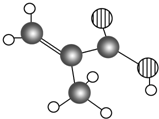 某化工厂产品只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表化学键,如单键、双键等).
某化工厂产品只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表化学键,如单键、双键等). .
.