题目内容
15.工业上用粗盐(含Ca2+、Mg2+、SO42-等杂质)为主要原料采用“侯氏制碱法”生产纯碱和化肥NH4Cl,工艺流程如下图所示.下列有关说法正确的是 ( )
| A. | 对粗盐溶液除杂可依次加入NaOH、Na2CO3、BaCl2,再加入盐酸调节溶液pH | |
| B. | 饱和食盐水中先通入的气体为CO2 | |
| C. | 流程图中的系列操作中一定需要玻璃棒 | |
| D. |  如图所示装置可以比较Na2CO3和NaHCO3晶体的热稳定性 |
分析 A、除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可以加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除钙离子和过量的钡离子,盐酸要放在最后,来除去过量的氢氧化钠和碳酸钠,加氢氧化钠和氯化钡无先后顺序要求;
B、二氧化碳在水中溶解度较小,氨气溶解度较大,故应先通入氨气;
C、从溶液中得到固体,需要加热浓缩,冷却结晶、过滤等操作,据此解答即可;
D、Na2CO3加热不易分解,NaHCO3晶体加热容易分解,据此解答即可.
解答 解:A、除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可以加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除钙离子和过量的钡离子,盐酸要放在最后,来除去过量的氢氧化钠和碳酸钠,故A错误;
B、二氧化碳在水中溶解度较小,氨气溶解度较大,故应先通入氨气,碱性溶液中再通入二氧化碳,二氧化碳的溶解度增大,可以达到实验目的,故B错误;
C、从溶液中得到固体,需要加热浓缩,冷却结晶、过滤等操作,这些过程中需要玻璃棒搅拌、引流等,故C正确;
D、Na2CO3加热不易分解,NaHCO3晶体加热容易分解,故小试管中盛放NaHCO3,大试管中盛放Na2CO3,NaHCO3间接加热能分解,Na2CO3直接加热不分解,能证明两者的稳定性,图中放反,故D错误,故选C.
点评 本题以纯碱工业为载体,考查的是粗盐的提纯、纯碱与小苏打热稳定性比较、气体通入顺序以及流程分析等,难度不大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
6.下列说法正确的是( )
| A. | 第ⅠA族元素的金属性比第ⅡA族元素的金属性强 | |
| B. | 可以在元素周期表中金属与非金属元素分界线附近寻找合适的半导体材料 | |
| C. | 同周期非金属氧化物对应的水化物的酸性从左到右依次增强 | |
| D. | 第三周期元素的离子半径从左到右逐渐减小 |
3.下列叙述正确的是( )
| A. | 非极性键不可能存在于离子化合物中 | |
| B. | 制催化剂的材料和制耐高温、耐腐蚀的合金材料可在过渡元素中寻找 | |
| C. | 1mol硫酸与足量氢氧化钠发生中和反应生成水所释放的热量称为中和热 | |
| D. | 单质分子中均不存在化学键 |
10. 下图装置可用于收集某气体并验证该气体的某些化学性质,下列选项正确的是( )
下图装置可用于收集某气体并验证该气体的某些化学性质,下列选项正确的是( )
 下图装置可用于收集某气体并验证该气体的某些化学性质,下列选项正确的是( )
下图装置可用于收集某气体并验证该气体的某些化学性质,下列选项正确的是( )| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A | SO2 | 品红溶液 | 溶液褪色 | SO2 有氧化性 |
| B | C2H4 | 溴水 | 溶液褪色 | C2H4能发生加成反应 |
| C | NH3 | 酚酞试液 | 溶液变红 | 氨水具有漂白性 |
| D | Cl2 | 紫色石蕊试液 | 溶液先变红后褪色 | 氯水具有酸性和漂白性 |
| A. | A | B. | B | C. | C | D. | D |
7.下列事实与氢键有关的是( )
| A. | 水结成冰体积膨胀 | |
| B. | 水加热到很高的温度都难以分解 | |
| C. | CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 | |
| D. | HF、HCl、HBr、HI的热稳定性依次减弱 |
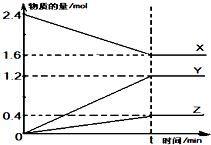 在2L容器中有3种物质进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t时刻达到平衡.
在2L容器中有3种物质进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t时刻达到平衡.