题目内容
10. 下图装置可用于收集某气体并验证该气体的某些化学性质,下列选项正确的是( )
下图装置可用于收集某气体并验证该气体的某些化学性质,下列选项正确的是( )| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A | SO2 | 品红溶液 | 溶液褪色 | SO2 有氧化性 |
| B | C2H4 | 溴水 | 溶液褪色 | C2H4能发生加成反应 |
| C | NH3 | 酚酞试液 | 溶液变红 | 氨水具有漂白性 |
| D | Cl2 | 紫色石蕊试液 | 溶液先变红后褪色 | 氯水具有酸性和漂白性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二氧化硫密度比空气大,可用向上排空法收集,具有漂白性;
B.乙烯不能利用排空气法收集;
C.氨气密度比空气小,不能用向上排空法收集;
D.氯气密度比空气大,可用向上排空法收集,氯水中含盐酸、HClO.
解答 解:A.二氧化硫密度比空气大,可用向上排空法收集,具有漂白性,则品红褪色,与其漂白性有关,与氧化性无关,故A错误;
B.乙烯不能利用排空气法收集,乙烯可与溴水发生加成反应,故B错误;
C.氨气密度比空气小,不能用向上排空法收集,氨水溶液显碱性,故C错误;
D.氯气密度比空气大,可用向上排空法收集,氯水中含盐酸、HClO,则紫色石蕊先变红后褪色,可知氯水具有酸性(H+)和漂白性(HClO),故D正确;
故选D.
点评 本题考查实验方案的评价,为高频考点,侧重于气体的收集和性质检验的考查,注意常见气体的收集方法,把握性质是解答的关键,题目难度不大.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
1.下列有关实验的叙述,正确的是( )
| A. | 分馏石油时,温度计的水银球必须插入液面以下 | |
| B. | 制备乙酸乙酯时,加料顺序为浓硫酸、乙醇、乙酸 | |
| C. | 配制银氨溶液时,将稀氨水慢慢滴加到稀硝酸银溶液中,产生白色沉淀后继续滴加,直至沉淀刚好溶解为止 | |
| D. | 实验室可用苯和溴水在Fe作催化剂的情况下制备溴苯 |
5.汽车在剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑,下列关于该反应的说法正确的是( )
| A. | 22.4LN2中σ键与π键个数比为1:2 | |
| B. | 反应物和生成物中只有氮气属于非电解质 | |
| C. | 该反应每转移1mol电子,有0.2molKNO3被氧化 | |
| D. | NaN3是只含离子键的离子化合物 |
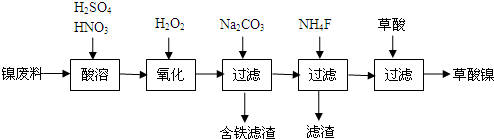
15.工业上用粗盐(含Ca2+、Mg2+、SO42-等杂质)为主要原料采用“侯氏制碱法”生产纯碱和化肥NH4Cl,工艺流程如下图所示.下列有关说法正确的是 ( )


| A. | 对粗盐溶液除杂可依次加入NaOH、Na2CO3、BaCl2,再加入盐酸调节溶液pH | |
| B. | 饱和食盐水中先通入的气体为CO2 | |
| C. | 流程图中的系列操作中一定需要玻璃棒 | |
| D. |  如图所示装置可以比较Na2CO3和NaHCO3晶体的热稳定性 |
2.下列关于硅原子的核外电子排布表示式(或排布图)中,错误的是( )
| A. | 1s22s22p63s23p2 | B. | [Ne]3s23p2 | ||
| C. | 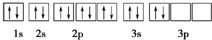 | D. |  |
19.在一个体积不变的密闭容器中发生可逆反应:A2(g)+B2(g)?2AB(g),达到平衡的标志是( )
| A. | 容器的总压强不随时间而变化 | |
| B. | 容器内气体的密度不再改变 | |
| C. | 单位时间内有nmolA2生成的同时有nmolB2消耗 | |
| D. | v正(A2)=2v逆(AB) |
20.(1)25℃下,0.1mol/L醋酸pH为4,则此温下,该浓度醋酸的电离度为0.1%;电离平衡常数为10-7,水电离出的c(H+)=10-10mol/L,加少量水稀释后,溶液中c(CH3COOH)c(CH3COO−)的值减小(填“增大”或“减小”)
(2)pH值相同的 HCl(aq)、H2SO4(aq)、CH3COOH(aq)各100mL
①三种溶液中物质的量浓度最大的是CH3COOH;
②分别用0.1mol/L的NaOH(aq)中和,消耗NaOH(aq)的体积分别为V1、V2、V3,它们由大到小的顺序是V3>V1=V2.
③反应开始时,反应速率D.(填A、HCl最快;B、H2SO4最快;C、CH3COOH最快;D、一样快)
(3)下表是不同温度下水的离子积数据:
试回答下列问题:
①若25<t1<t2,则α>1×10-14(填“>”“<”或“=”)
②25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 mol•L-1,取该溶液1mL,加水稀释至10mL,则稀释后溶液中c (Na+):c (OH-)=1000:1
③t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=9:11.此溶液中各种离子的浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(H+)>c(OH-)
(4)25℃时,若体积为Va,pH=a的某一元强酸与体积为Vb,pH=b的某一元强碱混合,恰好中和,且已知Va<Vb和a=0.5b,则a的取值范围是72<a<143.
(2)pH值相同的 HCl(aq)、H2SO4(aq)、CH3COOH(aq)各100mL
①三种溶液中物质的量浓度最大的是CH3COOH;
②分别用0.1mol/L的NaOH(aq)中和,消耗NaOH(aq)的体积分别为V1、V2、V3,它们由大到小的顺序是V3>V1=V2.
③反应开始时,反应速率D.(填A、HCl最快;B、H2SO4最快;C、CH3COOH最快;D、一样快)
(3)下表是不同温度下水的离子积数据:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
①若25<t1<t2,则α>1×10-14(填“>”“<”或“=”)
②25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 mol•L-1,取该溶液1mL,加水稀释至10mL,则稀释后溶液中c (Na+):c (OH-)=1000:1
③t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=9:11.此溶液中各种离子的浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(H+)>c(OH-)
(4)25℃时,若体积为Va,pH=a的某一元强酸与体积为Vb,pH=b的某一元强碱混合,恰好中和,且已知Va<Vb和a=0.5b,则a的取值范围是72<a<143.