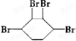
��Ŀ����
5��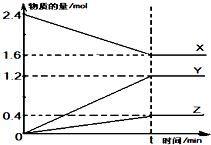 ��2L��������3�����ʽ��з�Ӧ��X��Y��Z�����ʵ�����ʱ��ı仯������ͼ��ʾ����Ӧ��tʱ�̴ﵽƽ�⣮
��2L��������3�����ʽ��з�Ӧ��X��Y��Z�����ʵ�����ʱ��ı仯������ͼ��ʾ����Ӧ��tʱ�̴ﵽƽ�⣮��1���÷�Ӧ�Ļ�ѧ����ʽ��2X?3Y+Z��
��2����Ӧ��ʼ��tʱ�̣�Y��ƽ����Ӧ������$\frac{0.6}{t}$mol/��L•min����
��3�����ڸ÷�Ӧ��˵������ȷ����C
A������tʱ�̸÷�Ӧ��ֹͣ
B�����������һ���ܼӿ췴Ӧ����
C����tʱ������Ӧ���ʵ����淴Ӧ����
D������ѹǿ��һ���ܼӿ췴Ӧ���ʣ�
���� ��1��ͼ���֪��0��tʱ�̣�n��X����С��n��Y������n��Z��������ȷ��XΪ��Ӧ�YZΪ��������ݷ�Ӧ�����ʱ仯�����ʵ���֮�ȵ��ڻ�ѧ������֮�ȣ�д����ѧ����ʽ��
��2����Ӧ��ʼ��tʱ�̣�Y�����ʵ����仯Ϊ1.2mol������v=$\frac{��c}{��t}$���㷴Ӧ���ʣ�
��3��ͼ�������֪����Ӧ�ǿ��淴Ӧ����Ӧ�����һ�������´ﵽƽ��״̬��
A������tʱ�̸÷�Ӧ�ﵽƽ���Ƕ�̬ƽ�⣻
B��������������Լӿ췴Ӧ����Ҳ���Լ�����Ӧ���ʣ�
C����tʱ�̴ﵽ��ѧƽ�⣻
D�����ʾۼ�״̬��֪������ѹǿ����һ���ܼӿ췴Ӧ���ʣ�
��� �⣺��1��ͼ���֪��0��tʱ�̣�n��X����С��n��Y������n��Z��������ȷ��XΪ��Ӧ�YZΪ�������n��X������n��Y������n��Z��0.8��1.2��0.4=2��3��1�����Է�Ӧ�Ļ�ѧ����ʽΪ��2X?3Y+Z��
�ʴ�Ϊ��2X?3Y+Z��
��2��v��Y��=$\frac{��c}{��t}$=$\frac{\frac{��n}{V}}{��t}$=$\frac{1.2mol}{2L��tmin}$=$\frac{0.6}{t}$mol/��L•min�����ʴ�Ϊ��$\frac{0.6}{t}$mol/��L•min����
��3��ͼ�������֪����Ӧ�ǿ��淴Ӧ����Ӧ�����һ�������´ﵽƽ��״̬��
A������tʱ�̸÷�Ӧ�ﵽƽ���Ƕ�̬ƽ�⣬��Ӧ����������ͬ�Ҳ�Ϊ0����A����
B��������������Լӿ췴Ӧ����Ҳ���Լ�����Ӧ���ʣ���һ������Ӧ���ʣ���B����
C����tʱ�̣����ʵ������䣬˵����Ӧ�ﵽ��ѧƽ�⣬��C��ȷ��
D�����ʾۼ�״̬��֪������ѹǿ����һ���ܼӿ췴Ӧ���ʣ��ʴ���
�ʴ�Ϊ��C��
���� ���⿼���˻�ѧͼ������жϣ���ѧ��Ӧ���ʸ���ļ���Ӧ�ã�ע�ⷴӦ�ﵽƽ��״̬�ķ����жϣ���Ŀ�Ѷ��еȣ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| A�� | �Դ�����Һ���ӿ����μ���NaOH��Na2CO3��BaCl2���ټ������������ҺpH | |
| B�� | ����ʳ��ˮ����ͨ�������ΪCO2 | |
| C�� | ����ͼ�е�ϵ�в�����һ����Ҫ������ | |
| D�� |  ��ͼ��ʾװ�ÿ��ԱȽ�Na2CO3��NaHCO3��������ȶ��� |
| A�� | 500��ʱ�����¸������ںϳɰ��ķ�Ӧ | |
| B�� | ����ɫ��NO2��ѹ����ɫ�ȱ�����dz | |
| C�� | SO2��������SO3�ķ�Ӧ��������������Ŀ��� | |
| D�� | ʵ�����г����ű���ʳ��ˮ�ķ����ռ����� |
��2��pHֵ��ͬ�� HCl��aq����H2SO4��aq����CH3COOH��aq����100mL
��������Һ�����ʵ���Ũ��������CH3COOH��
�ڷֱ���0.1mol/L��NaOH��aq���кͣ�����NaOH��aq��������ֱ�ΪV1��V2��V3�������ɴ�С��˳����V3��V1=V2��
�۷�Ӧ��ʼʱ����Ӧ����D������A��HCl��죻B��H2SO4��죻C��CH3COOH��죻D��һ���죩
��3���±��Dz�ͬ�¶���ˮ�����ӻ����ݣ�
| �¶�/�� | 25 | t1 | t2 |
| ˮ�����ӻ����� | 1��10-14 | �� | 1��10-12 |
����25��t1��t2�������1��10-14���������������=����
��25���£�ijNa2SO4��Һ��c��SO42-��=5��10-4 mol•L-1��ȡ����Һ1mL����ˮϡ����10mL����ϡ�ͺ���Һ��c ��Na+����c ��OH-��=1000��1
��t2���£���pH=11�Ŀ�������ҺV1 L��pH=1��ϡ����V2 L��ϣ����Ϻ���Һ�����Ϊԭ����Һ���֮�ͣ������û����Һ��pH=2����V1��V2=9��11������Һ�и������ӵ�Ũ���ɴ�С������˳����c��Na+����c��SO42-����c��H+����c��OH-��
��4��25��ʱ�������ΪVa��pH=a��ijһԪǿ�������ΪVb��pH=b��ijһԪǿ���ϣ�ǡ���кͣ�����֪Va��Vb��a=0.5b����a��ȡֵ��Χ��$\frac{7}{2}$��a��$\frac{14}{3}$��
| A�� | Y2Ϊ0.1 mol•L-1 | B�� | X2Ϊ0.1 mol•L-1 | ||
| C�� | Y2Ϊ0.35 mol•L-1 | D�� | ZΪ0.3 mol•L-1 |
| A�� | $\frac{10}{11}$ | B�� | $\frac{4}{25}$ | C�� | $\frac{4}{11}$ | D�� | $\frac{4}{5}$ |
| A�� | 1mol���к�������ĿΪ7NA | |
| B�� | ��״���£�22.4L�����й��ۼ���ĿΪ19NA | |
| C�� | 14g��ϩ�Ͷ�ϩ�Ļ�����к��е�ԭ������Ϊ3NA�� | |
| D�� | 1mol����ϩ��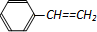 ���к��е�C=C��Ϊ4NA ���к��е�C=C��Ϊ4NA |
 ��X��Y�γɵ����ӻ�����ĵ���ʽΪ
��X��Y�γɵ����ӻ�����ĵ���ʽΪ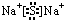 ��Z��Y������������Ӧ��ˮ���ﷴӦ�����ӷ���ʽΪH++OH-=H2O��
��Z��Y������������Ӧ��ˮ���ﷴӦ�����ӷ���ʽΪH++OH-=H2O��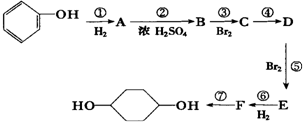 ��֪ʵ������
��֪ʵ������  �ϳ�
�ϳ� �ķ�Ӧ�������� �������Լ��ͷ�Ӧ��������ȥ�� ��X����±��ԭ�ӣ�R����������
�ķ�Ӧ�������� �������Լ��ͷ�Ӧ��������ȥ�� ��X����±��ԭ�ӣ�R���������� ��D
��D
 ��
��