题目内容
1.由H2、O2、CO2组成的混合气体的密度是同温同压下CH4密度的2倍,三种气体组分的物质的量之比不可能是( )| A. | 2:3:5 | B. | 2:5:5 | C. | 2:1:5 | D. | 2:2:7 |
分析 混合气体的密度是CH4密度的2倍,则混合气体平均相对分子质量为:16×2=32,O2的相对分子质量是32,其含量多少不影响相对密度,只要氢气和CO2的平均摩尔质量为32即可,设氢气的物质的量为x、CO的物质的量为y,然后根据平均分子量为32列式计算.
解答 解:由H2、O2、CO组成的混合气体的密度是同温同压下CH4密度的2倍,则混合气体的平均分子量为:16×2=32,
由于O2的相对分子质量是32,其含量多少不影响相对密度,
设氢气的物质的量为x、二氧化碳的物质的量为y,二者的平均分子量一定为32,
则:2x+44yx+y2x+44yx+y=32,整理可得:x:y=2:5,
所以满足条件的为:A、B、C,错误的为D,
故选D.
点评 本题考查了混合物的计算,题目难度中等,明确相对密度与相对分子量之间的关系为解答关键,注意掌握平均分子量的计算方法及其应用,试题培养了学生的分析能力及灵活应用基础知识的能力.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
12.下列物质中,同时含有氯分子、氯离子的是( )
| A. | 氯水 | B. | 液氯 | C. | 漂白粉 | D. | 氯化镁 |
9.下列有关污染的叙述,正确的是( )
| A. | 酸雨主要是空气中的SO2,溶于雨水中形成的 | |
| B. | 破坏臭氧层的主要物质是氟氯烃等物质 | |
| C. | 温室效应主要是因空气中CO2浓度增高造成的 | |
| D. | 居室装修释放的甲醛不会伤害人体健康 |
16.“固体离子导体”是因为离子能在固体中迁移传递电荷.如图,空气中的O2与AlI3在聚四氟乙烯膜中反应生成I2,I2与Ag形成原电池,在RbAg4I5晶体中迁移的离子全是Ag+.下列说法中错误的是( )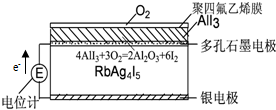

| A. | 电子从银电极在RbAg4I5晶体中迁移流向石墨电极 | |
| B. | Ag+从下往上移动 | |
| C. | 石墨电极为正极,银电极为负极 | |
| D. | 银电极的电极反应是:Ag-e-=Ag+ |
13.下列化合物中,不能通过化合反应直接制取的是( )
| A. | FeCl2 | B. | Fe(OH)3 | C. | NaOH | D. | H2SiO3 |
12.下列化学反应的离子方程式正确的是( )
| A. | 氧化亚铁加入稀硝酸:FeO+2H+=Fe2++H2O | |
| B. | 硅酸钠水溶液中通入足量的二氧化碳:SiO32-+CO2+2H2O=H2SiO3(胶体)+CO32- | |
| C. | 碳酸氢铵溶液和足量氢氧化钠溶液混合:HCO3-+OH-=CO32-+H2O | |
| D. | 铝片加入烧碱溶液:2Al+2OH-+2H2O=2AlO2-+3H2↑ |
13.由M、N两种烃组成的混合物,当混合物质量一定时,无论M、N以何种比例混合,完全燃烧消耗氧气的质量为一恒量.对M、N两种烃的下面几种判断,正确的是( )
| A. | 一定互为同分异构体 | B. | 一定互为同系物 | ||
| C. | 具有相同的最简式 | D. | 烃中碳原子数一定相同 |