题目内容
12.下列化学反应的离子方程式正确的是( )| A. | 氧化亚铁加入稀硝酸:FeO+2H+=Fe2++H2O | |
| B. | 硅酸钠水溶液中通入足量的二氧化碳:SiO32-+CO2+2H2O=H2SiO3(胶体)+CO32- | |
| C. | 碳酸氢铵溶液和足量氢氧化钠溶液混合:HCO3-+OH-=CO32-+H2O | |
| D. | 铝片加入烧碱溶液:2Al+2OH-+2H2O=2AlO2-+3H2↑ |
分析 A.发生氧化还原反应生成硝酸铁、NO和水;
B.反应生成硅酸和碳酸氢钠;
C.漏写铵根离子与碱的反应;
D.反应生成偏铝酸钠和氢气,遵循电子、电荷守恒.
解答 解:A.氧化亚铁加入稀硝酸的离子反应为3FeO+NO3-+10H+=3Fe3++NO↑+5H2O,故A错误;
B.硅酸钠水溶液中通入足量的二氧化碳的离子反应为SiO32-+2CO2+2H2O=H2SiO3(胶体)+2HCO3-,故B错误;
C.碳酸氢铵溶液和足量氢氧化钠溶液混合的离子反应为NH4++HCO3-+2OH-=CO32-+H2O+NH3.H2O,故C错误;
D.铝片加入烧碱溶液的离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应及复分解反应的离子反应考查,题目难度不大.

练习册系列答案
 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
20.溶液酸碱性探究题
25℃时,某化学兴趣小组在测定酸碱中和滴定曲线的活动中,从实验室领取一瓶一元酸(HA)和一瓶pH=11的碱(BOH)溶液.由于标签破损不知道是何种酸,测得该酸溶液的pH=3.为了进一步认识该酸,请你参与该兴趣小组同学设计实验方案.
(1)证明该一元酸是不是盐酸:
(2)探究HA是强酸还是弱酸:取上述HA和BOH的溶液各20mL混合后溶液的pH=5,试推测HA是强酸还是弱酸.你的结论是弱酸;如果酸是强酸,当体积相等时,pH=3的HA和pH=11的BOH反应只能是中性或碱性,而反应后溶液的pH=5为酸性,所以HA必为弱酸.
(3)若HA是强酸、BOH是强碱,现将此HA溶液和BOH溶液按一定体积比混合后测得溶液的pH=4(设混合后溶液的体积变化忽略不计).则混合时酸和碱的体积之比为V(HA):V(BOH)=11:9.
(4)若HA是强酸,pH=a,BOH是强碱,pH=b,已知a+b=12,两种溶液混合后溶液pH=7,则酸溶液体积V(酸)和碱溶液体积V(碱)的倍数关系是V(碱)100V(酸).
25℃时,某化学兴趣小组在测定酸碱中和滴定曲线的活动中,从实验室领取一瓶一元酸(HA)和一瓶pH=11的碱(BOH)溶液.由于标签破损不知道是何种酸,测得该酸溶液的pH=3.为了进一步认识该酸,请你参与该兴趣小组同学设计实验方案.
(1)证明该一元酸是不是盐酸:
| 滴加试剂 | 所根据的现象 | 结论 |
| 不是盐酸 |
(3)若HA是强酸、BOH是强碱,现将此HA溶液和BOH溶液按一定体积比混合后测得溶液的pH=4(设混合后溶液的体积变化忽略不计).则混合时酸和碱的体积之比为V(HA):V(BOH)=11:9.
(4)若HA是强酸,pH=a,BOH是强碱,pH=b,已知a+b=12,两种溶液混合后溶液pH=7,则酸溶液体积V(酸)和碱溶液体积V(碱)的倍数关系是V(碱)100V(酸).
1.由H2、O2、CO2组成的混合气体的密度是同温同压下CH4密度的2倍,三种气体组分的物质的量之比不可能是( )
| A. | 2:3:5 | B. | 2:5:5 | C. | 2:1:5 | D. | 2:2:7 |
18.下列关于胶体的认识正确的是( )
| A. | 鸡蛋清在水中形成的分散系是一种液溶胶,往其中加入饱和(NH4)2SO4溶液会生成白色沉淀 | |
| B. | 可用丁达尔效应来区分胶体和溶液 | |
| C. | 胶体中存在布朗运动,其他分散系中不存在布朗运动 | |
| D. | 某纯净纳米材料其粒子直径从几纳米到几十纳米,该纳米材料属于胶体 |
7.氯苯是重要的有机化工产品,是燃料、医药、有机合成的中间体,工业上常用“间歇法”制取.反应原理、实验装置图(加热装置都已略去)如下:

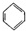 +Cl2$\stackrel{FeCl_{3}}{→}$
+Cl2$\stackrel{FeCl_{3}}{→}$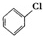 +HCl
+HCl
回答下列问题:
(1)A反应器是利用实验室法制取氯气,中空玻璃管B的作用是平衡气压.冷凝管中冷水应从a(填“a”或“b”)处通入.
(2)把干燥的氯气通入装有干燥笨的反应器C中(内有相当于笨量1%的铁屑作催化剂).
加热维持反应温度在40-60℃为宜,温度过高回生成过多的二氯苯.
①对C加热的方法时c(填序号).
a.酒精灯加热b.油浴加热c.水浴加热
②D出口的气体成份有HCl、苯蒸汽和氯气.
(3)C反应器反应完成后,工业上要进行水洗,碱洗以及食盐干燥,才能蒸馏.
①碱洗之前要水洗的目的是洗去一部分无机物,同时为了减少碱的用量,节约成本.
②写出用10%氢氧化钠溶液碱洗时可能发生的化学反应方程式:FeCl3+3NaOH=Fe(OH)3↓+3NaCl、HCl+NaOH=NaCl+H2O等.
(写两个即可)
(4)上述装置图中A、C反应器之间,需要增添一U型管,其内置物质是五氧化二磷或氯化钙.
(5)工业生产中苯的流失情况如下:
则1t苯可制得成品为$\frac{(1-0.0892)×112.5}{78}$t(只要求列式)

 +Cl2$\stackrel{FeCl_{3}}{→}$
+Cl2$\stackrel{FeCl_{3}}{→}$ +HCl
+HCl回答下列问题:
(1)A反应器是利用实验室法制取氯气,中空玻璃管B的作用是平衡气压.冷凝管中冷水应从a(填“a”或“b”)处通入.
(2)把干燥的氯气通入装有干燥笨的反应器C中(内有相当于笨量1%的铁屑作催化剂).
加热维持反应温度在40-60℃为宜,温度过高回生成过多的二氯苯.
①对C加热的方法时c(填序号).
a.酒精灯加热b.油浴加热c.水浴加热
②D出口的气体成份有HCl、苯蒸汽和氯气.
(3)C反应器反应完成后,工业上要进行水洗,碱洗以及食盐干燥,才能蒸馏.
①碱洗之前要水洗的目的是洗去一部分无机物,同时为了减少碱的用量,节约成本.
②写出用10%氢氧化钠溶液碱洗时可能发生的化学反应方程式:FeCl3+3NaOH=Fe(OH)3↓+3NaCl、HCl+NaOH=NaCl+H2O等.
(写两个即可)
(4)上述装置图中A、C反应器之间,需要增添一U型管,其内置物质是五氧化二磷或氯化钙.
(5)工业生产中苯的流失情况如下:
| 项目 | 二氯苯 | 尾气 | 不确定苯耗 | 流失总量 |
| 苯流失量(kg/t) | 13 | 24.9 | 51.3 | 89.2 |
4.表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填具体元素符号,下同).
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是: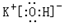 .
.
(3)①~⑨中元素M的最高价氧化物的水化物是两性氢氧化物.则元素M在周期表中的位置是第3周期第ⅢA族(填写具体的周期数和族序数);写出M的氧化物与氢氧化钠溶液反应的化学方程式Al2O3+2NaOH=2NaAlO2+H2O.
(4)用电子式表示元素④与⑥的简单化合物的形成过程: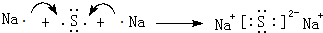 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.
(5)由元素②形成的单质的电子式是: ,该物质是由非极性键(填“极性”或“非极性”)键形成的.
,该物质是由非极性键(填“极性”或“非极性”)键形成的.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是:
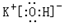 .
.(3)①~⑨中元素M的最高价氧化物的水化物是两性氢氧化物.则元素M在周期表中的位置是第3周期第ⅢA族(填写具体的周期数和族序数);写出M的氧化物与氢氧化钠溶液反应的化学方程式Al2O3+2NaOH=2NaAlO2+H2O.
(4)用电子式表示元素④与⑥的简单化合物的形成过程:
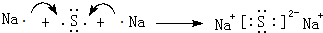 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.(5)由元素②形成的单质的电子式是:
 ,该物质是由非极性键(填“极性”或“非极性”)键形成的.
,该物质是由非极性键(填“极性”或“非极性”)键形成的.
1.食品包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同.下列分析正确的是( )
| A. | 含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) | |
| B. | 脱氧过程中铁作原电池负极,电极反应为:Fe-3e-=Fe3+ | |
| C. | 脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e-=4OH- | |
| D. | 加入脱氧剂的目的是因为该反应是吸热过程,可降低温度,延长食品保质期 |
2.某化合物在核磁共振氢谱中出现6个峰,其结构简式可能是( )
| A. |  | B. | 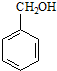 | C. |  | D. | 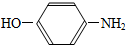 |
 第29届奥运会期间,作为马拉松领跑车和电视拍摄车的汽车,
第29届奥运会期间,作为马拉松领跑车和电视拍摄车的汽车,