题目内容
6.Cl2是一种重要的化工原料,如图是一些含氯产品.
(1)①中钢瓶上应贴的标签为C.
A.腐蚀品 B.爆炸品 C.有毒品 D.易燃品
(2)下列有关漂白粉和漂白液的说法正确的是B.
A.漂白粉是纯净物,漂白液是混合物 B.漂白粉的有效成分是Ca(ClO)2
C.工业上将氯气通入澄清石灰水制取漂白粉 D.漂白液的有效成分是Na2O2
(3)工业上利用Cl2制盐酸,其化学方程式为H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl.Cl2溶于水可制得氯水,检验一瓶氯水是否已经完全变质,可选用的试剂是D.
A.硝酸银溶液 B.酚酞溶液 C.碳酸钠溶液 D.紫色石蕊溶液
(4)将8.7g MnO2与足量浓盐酸混合加热,反应生成氯气的体积(标准状况)是2.24L;被氧化的HCl的质量是7.3g.
(5)如图是实验室用KMnO4与浓盐酸制取适量氯气的简易装置.
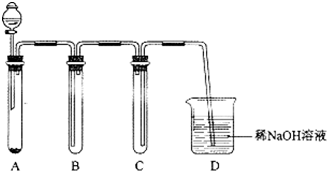
装置B、C、D的作用分别是:
B向上排气收集氯气;C安全作用,防止D中的液体倒吸进入集气管B中;
D吸收尾气,防止氯气扩散到空气中污染环境.
分析 (1)氯气为有毒的气体;
(2)漂白粉的主要成分为Ca(ClO)2、CaCl2,有效成分是Ca(ClO)2,漂白液的有效成分为NaClO;
(3)氢气与氯气反应生成HCl,溶于水得到盐酸;氯水中HClO不稳定,若变质生成盐酸,酸性增强;
(4)MnO2完全反应,根据n=$\frac{m}{M}$计算8.7g的MnO2的物质的量,再根据方程式计算氯气的体积,被氧化的HCl生成生成氯气,根据氯原子守恒可知n被氧化(HCl)=2n(Cl2),根据m=nM计算质量;
(5)实验室用高锰酸钾和浓盐酸在常温下反应制备氯气,用向上排空法收集,为防止倒吸,C起到安全瓶的作用,为防止污染空气,应进行尾气处理.
解答 解:(1)氯气为有毒的气体,则①中钢瓶上应贴的标签为C,不易燃、易爆,本身不具有腐蚀性,故答案为:C;
(2)A.漂白粉的主要成分为Ca(ClO)2、CaCl2,漂白液的有效成分为NaClO,均为混合物,故A错误;
B.漂白粉的有效成分是Ca(ClO)2,含ClO-具有强氧化性,可用于漂白,故B正确;
C.石灰水的浓度较小,工业上将氯气通入石灰乳中制取漂白粉,故C错误;
D.过氧化钠与水反应,而漂白液的有效成分是NaClO,故D错误;
故答案为:B;
(3)氢气与氯气反应生成HCl,溶于水得到盐酸,发生的反应为H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl;氯水中HClO不稳定,若变质生成盐酸,酸性增强,可选紫色石蕊检验,氯水、盐酸与A、B、C混合的现象均相同,不能鉴别,故答案为:H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl;D;
(4)8.7g的MnO2的物质的量=$\frac{8.7g}{87g/mol}$=0.1mol,则:
MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
1mol 22.4L
0.1mol V
V=$\frac{0.1mol×22.4L/mol}{1mol}$=2.24L;
被氧化的HCl生成氯气,根据氯原子守恒可知n被氧化(HCl)=2n(Cl2)=2×$\frac{2.24L}{22.4L/mol}$=0.2mol,
m被氧化(HCl)=0.2mol×36.5g/mol=7.3g;
故答案为:2.24;7.3g.
(5)实验室用高锰酸钾和浓盐酸在常温下反应制备氯气,用向上排空法收集,为防止倒吸,C起到安全瓶的作用,为防止污染空气,应进行尾气处理,
故答案为:向上排气收集氯气;安全作用,防止D中的液体倒吸进入集气管B中;吸收尾气,防止氯气扩散到空气中污染环境.
点评 本题考查较综合,涉及物质的性质、氧化还原反应计算等,注重高频考点的考查,把握氯气的性质、氯水的成分及物质性质与用途的关系等为解答的关键,侧重分析、应用及计算能力的考查,题目难度不大.

 全能测控一本好卷系列答案
全能测控一本好卷系列答案| A. | 加工成饲料 | B. | 发酵后作农家肥 | C. | 就地焚烧 | D. | 制造沼气 |
| A. | CuCl2 | B. | CaCl2 | C. | K2SO4 | D. | ZnSO4 |
| A. | 吸烟产生的尼古丁和一氧化碳属于室内空气污染物 | |
| B. | 吸入一氧化碳、焦油、尼古丁可导致肺部发生病变 | |
| C. | 吸烟会影响中学生健康人格的形成 | |
| D. | 吸烟对公共环境没有影响 |
| A. | 2:3:5 | B. | 2:5:5 | C. | 2:1:5 | D. | 2:2:7 |
| A. | 酸性溶液中:Al3+、Fe3+、SO42-、SCN- | |
| B. | 透明溶液中:MnO4-、K+、Na+、NO3- | |
| C. | FeCl3溶液中:Na+、K+、SO42-、I- | |
| D. | 强酸性溶液中:Na+、Fe2+、SO42-、NO3- |
| A. | 鸡蛋清在水中形成的分散系是一种液溶胶,往其中加入饱和(NH4)2SO4溶液会生成白色沉淀 | |
| B. | 可用丁达尔效应来区分胶体和溶液 | |
| C. | 胶体中存在布朗运动,其他分散系中不存在布朗运动 | |
| D. | 某纯净纳米材料其粒子直径从几纳米到几十纳米,该纳米材料属于胶体 |
| A. | C4H6、C3H8 | B. | C2H2、C6H6 | C. | C2H6O、C2H4 | D. | C3H6、C3H8 |
 第29届奥运会期间,作为马拉松领跑车和电视拍摄车的汽车,
第29届奥运会期间,作为马拉松领跑车和电视拍摄车的汽车,