题目内容
13.下列化合物中,不能通过化合反应直接制取的是( )| A. | FeCl2 | B. | Fe(OH)3 | C. | NaOH | D. | H2SiO3 |
分析 A.FeCl3和Fe反应生成FeCl2;
B.Fe(OH)2被氧气氧化生成Fe(OH)3;
C.Na2O和水反应生成NaOH;
D.SiO2和水不反应.
解答 解:A.2FeCl3+Fe=3FeCl2,所以可以通过化合反应制取氯化亚铁,故A不选;
B.4Fe(OH)2+O2+2H2O=4Fe(OH)3,所以可以通过化合反应制取氢氧化铁,故B不选;
C.Na2O+H2O=2NaOH,所以可以通过化合反应制取NaOH,故C不选;
D.SiO2和水不反应,所以不能通过化合反应制取硅酸,应该用NaOH溶液制取硅酸钠,然后用硅酸钠和酸反应制取硅酸,故D选;
故选D.
点评 本题考查物质之间的转化,侧重考查元素化合物知识,明确常见物质的性质及常见化学反应是解本题关键,知道硅酸的制取方法,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.为了降低硫氧化物造成的空气污染,一种方法是在含硫燃料(如煤)燃烧过程中加入生石灰,这种方法叫“钙基固硫”,采用这种方法在燃料燃烧过程中的“固硫”反应为( )
| A. | 2CaO+2S=2CaS+O2↑ | B. | S+O2=SO2 | ||
| C. | CaO+SO2=CaSO3 | D. | 2CaSO3+O2=2CaSO4 |
4.下列实验中,①配制一定物质的量浓度的溶液 ②pH试纸的使用 ③过滤 ④蒸发 ⑤溶解,均用到的仪器是( )
| A. | 烧杯 | B. | 漏斗 | C. | 玻璃棒 | D. | 胶头滴管 |
1.由H2、O2、CO2组成的混合气体的密度是同温同压下CH4密度的2倍,三种气体组分的物质的量之比不可能是( )
| A. | 2:3:5 | B. | 2:5:5 | C. | 2:1:5 | D. | 2:2:7 |
18.下列关于胶体的认识正确的是( )
| A. | 鸡蛋清在水中形成的分散系是一种液溶胶,往其中加入饱和(NH4)2SO4溶液会生成白色沉淀 | |
| B. | 可用丁达尔效应来区分胶体和溶液 | |
| C. | 胶体中存在布朗运动,其他分散系中不存在布朗运动 | |
| D. | 某纯净纳米材料其粒子直径从几纳米到几十纳米,该纳米材料属于胶体 |
7.氯苯是重要的有机化工产品,是燃料、医药、有机合成的中间体,工业上常用“间歇法”制取.反应原理、实验装置图(加热装置都已略去)如下:

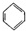 +Cl2$\stackrel{FeCl_{3}}{→}$
+Cl2$\stackrel{FeCl_{3}}{→}$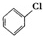 +HCl
+HCl
回答下列问题:
(1)A反应器是利用实验室法制取氯气,中空玻璃管B的作用是平衡气压.冷凝管中冷水应从a(填“a”或“b”)处通入.
(2)把干燥的氯气通入装有干燥笨的反应器C中(内有相当于笨量1%的铁屑作催化剂).
加热维持反应温度在40-60℃为宜,温度过高回生成过多的二氯苯.
①对C加热的方法时c(填序号).
a.酒精灯加热b.油浴加热c.水浴加热
②D出口的气体成份有HCl、苯蒸汽和氯气.
(3)C反应器反应完成后,工业上要进行水洗,碱洗以及食盐干燥,才能蒸馏.
①碱洗之前要水洗的目的是洗去一部分无机物,同时为了减少碱的用量,节约成本.
②写出用10%氢氧化钠溶液碱洗时可能发生的化学反应方程式:FeCl3+3NaOH=Fe(OH)3↓+3NaCl、HCl+NaOH=NaCl+H2O等.
(写两个即可)
(4)上述装置图中A、C反应器之间,需要增添一U型管,其内置物质是五氧化二磷或氯化钙.
(5)工业生产中苯的流失情况如下:
则1t苯可制得成品为$\frac{(1-0.0892)×112.5}{78}$t(只要求列式)

 +Cl2$\stackrel{FeCl_{3}}{→}$
+Cl2$\stackrel{FeCl_{3}}{→}$ +HCl
+HCl回答下列问题:
(1)A反应器是利用实验室法制取氯气,中空玻璃管B的作用是平衡气压.冷凝管中冷水应从a(填“a”或“b”)处通入.
(2)把干燥的氯气通入装有干燥笨的反应器C中(内有相当于笨量1%的铁屑作催化剂).
加热维持反应温度在40-60℃为宜,温度过高回生成过多的二氯苯.
①对C加热的方法时c(填序号).
a.酒精灯加热b.油浴加热c.水浴加热
②D出口的气体成份有HCl、苯蒸汽和氯气.
(3)C反应器反应完成后,工业上要进行水洗,碱洗以及食盐干燥,才能蒸馏.
①碱洗之前要水洗的目的是洗去一部分无机物,同时为了减少碱的用量,节约成本.
②写出用10%氢氧化钠溶液碱洗时可能发生的化学反应方程式:FeCl3+3NaOH=Fe(OH)3↓+3NaCl、HCl+NaOH=NaCl+H2O等.
(写两个即可)
(4)上述装置图中A、C反应器之间,需要增添一U型管,其内置物质是五氧化二磷或氯化钙.
(5)工业生产中苯的流失情况如下:
| 项目 | 二氯苯 | 尾气 | 不确定苯耗 | 流失总量 |
| 苯流失量(kg/t) | 13 | 24.9 | 51.3 | 89.2 |
4.表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填具体元素符号,下同).
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是: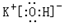 .
.
(3)①~⑨中元素M的最高价氧化物的水化物是两性氢氧化物.则元素M在周期表中的位置是第3周期第ⅢA族(填写具体的周期数和族序数);写出M的氧化物与氢氧化钠溶液反应的化学方程式Al2O3+2NaOH=2NaAlO2+H2O.
(4)用电子式表示元素④与⑥的简单化合物的形成过程: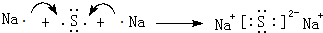 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.
(5)由元素②形成的单质的电子式是: ,该物质是由非极性键(填“极性”或“非极性”)键形成的.
,该物质是由非极性键(填“极性”或“非极性”)键形成的.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是:
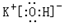 .
.(3)①~⑨中元素M的最高价氧化物的水化物是两性氢氧化物.则元素M在周期表中的位置是第3周期第ⅢA族(填写具体的周期数和族序数);写出M的氧化物与氢氧化钠溶液反应的化学方程式Al2O3+2NaOH=2NaAlO2+H2O.
(4)用电子式表示元素④与⑥的简单化合物的形成过程:
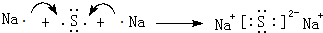 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.(5)由元素②形成的单质的电子式是:
 ,该物质是由非极性键(填“极性”或“非极性”)键形成的.
,该物质是由非极性键(填“极性”或“非极性”)键形成的.
5.元素周期表短周期的一部分.其中F原子的电子层数为n,最外层电子数为2n+1,核内质子数为2n2-1.下列说法不正确的是( )
| A | B | C | |
| D | E | F |
| A. | D的单质是常见的半导体材料 | |
| B. | B与E形成的化合物不只一种 | |
| C. | C与F的原子序数之差为8 | |
| D. | A的最高价氧化物的水化物能和Al(OH)3反应 |