题目内容
仿照电极方程式的书写,我们可以把一些氧化还原反应分成“氧化反应”和“还原反应”两个“半反应”,如Fe+2H+=Fe2++H2↑可分成氧化反应:Fe-2e-= Fe2+还原反应:2H++2e-= H2↑则下列正确的是( )
①Fe+2Fe3+=3Fe2+可分成 氧化反应:Fe-2e-= Fe2+ 还原反应:2 Fe3+ + 2e-=2 Fe2+
②MnO2+2Cl-+4H+=Mn2++Cl2↑+2H2O可分为
氧化反应:2Cl--2e-=Cl2↑ 还原反应:MnO2+2e-+4H+=Mn2++2H2O
③Cl2+H2S=S↓+2H++2Cl- 氧化反应:H2S- 2e-=S↓+ 2H+ 还原反应:Cl2+ 2e-=2Cl-
| A.③ | B.②③ | C.①② | D.①②③ |
D
解析试题分析:①符合拆分原则,正确;②符合两个半反应的书写要求,正确;③符合两个半反应的书写要求,正确。因此选项是D。
考点:考查氧化还原反应拆写成两个半反应的知识。

(1)M由两种短周期元素组成,每个M分子含有18个电子,其分子球棍模型如图所示。测得M的摩尔质量为32g/mol。画出编号为2的原子结构示意图: 。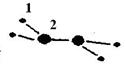
(2)已知1.0mol·L—1NaHSO3溶液的pH为3.5,加入氯水,振荡后溶液pH迅速降低。溶液pH降低的原因是 (用离子方程式表示)。
(3)在常温常压和光照条件下,N2在催化剂(TiO2)表面与H2O反应,生成1molNH3和O2时的能量变化值为382.5kJ,达到平衡后此反应NH3生成量与温度的实验数据如下表。则该反应的热化学方程式为 。
| T/K | 303 | 313 | 323 |
| NH3生成量/(10—1mol) | 4.3 | 5.9 | 6.0 |
(4)在溶液中,一定浓度的NH4+能溶解部分Mg(OH)2固体,反应如下:
2NH4+(aq) + Mg(OH)2(s)
 Mg2+(aq) +2NH3·H2O(aq)
Mg2+(aq) +2NH3·H2O(aq) 写出上述反应的平衡常数表达式
某研究性学习小组为探究Mg2+与NH3·H2O反应形成沉淀的情况,设计如下两组实验
| 实验① | 等体积1 mol/L氨水和0.1 mol/L MgCl2溶液混合 | 生成白色沉淀 |
| 实验② | 等体积0.1 mol/L氨水和1 mol/L MgCl2溶液混合 | 无现象 |
请分析实验①、②产生不同现象的原因: 。
(5)在室温下,化学反应I—(aq)+ ClO—(aq)=IO—(aq) + Cl—(aq)的反应物初始浓度、溶液中的氢氧根离子初始浓度及初始速率间的关系如下表所示:
| 实验编号 | I—的初始浓度 (mol·L—1) | ClO—的初始浓度 (mol·L—1) | OH—的初始浓度 (mol·L—1) | 初始速率v (mol·L—1· s—1) |
| 1 | 2 × 10—3 | 1.5 × 10—3 | 1.00 | 1.8 × 10—4 |
| 2 | a | 1.5 × 10—3 | 1.00 | 3.6 × 10—4 |
| 3 | 2 × 10—3 | 3 × 10—3 | 2.00 | 1.8 × 10—4 |
| 4 | 4 × 10—3 | 3 × 10—3 | 1.00 | 7.2 × 10—4 |
已知表中初始反应速率与有关离子浓度关系可以表示为v=" k" [I—]1 [ClO—]b [OH—]c(温度一定时,k为常数)。
①设计实验2和实验4的目的是 ;
②若实验编号4的其它浓度不变,仅将溶液的酸碱值变更为pH = 13,反应的初始速率v= 。
同位素示踪法可用于反应机理的研究,下列反应或转化中同位素示踪表示正确的是( )
| A.2Na218O2 + 2H2O ="=" 4Nal8OH + O2↑ |
| B.NaH+D2O===NaOH+D2↑ |
| C.2KMnO4 + 5H218O2 + 3H2SO4 ="=" K2SO4 + 2MnSO4 + 518O2↑+ 8H2O |
| D.K37ClO3 + 6HCl ="=" K37Cl + 3Cl2↑+ 3H2O |
2005年诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂。工业上冶炼钼的化学原理为:( )
①2MoS2+7O2=(高温)2MoO3+4SO2; ②MoO3+2NH3·H2O=(NH4)2MoO4+H2O;
③(NH4)2MoO4+2HCl=H2MoO4↓+2NH4Cl; ④H2MoO4=(△)MoO3+H2O;
⑤用还原剂将MoO3还原成金属钼。则下列说法正确的是
| A.MoS2煅烧产生的尾气可直接排入空气中 |
| B.MoO3是金属氧化物,也是碱性氧化物 |
| C.H2MoO4是一种强酸 |
| D.利用H2、CO和铝分别还原等量的MoO3,消耗还原剂的物质的量比为3:3:2 |
用Pt电极电解含有Cu2+和X3+各0.1 mol 的溶液,阴极析出固体物质的质量m g与溶液中通过电子的物质的量n mol的关系如图。则离子的氧化能力由大到小排列正确的是( )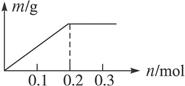
| A.Cu2+>X3+>H+ | B.H+>X3+>Cu2+ |
| C.Cu2+>H+>X3+ | D.X3+>H+>Cu2+ |
下列反应中,氧化剂与还原剂物质的量的关系为1:2的是
| A.4KI+O2+2H2O=4KOH+2I2 |
| B.2CH3COOH+Ca(ClO)2=2HClO+(CH3COO)2 Ca |
| C.I2+2NaClO3=2NaIO3+Cl2 |
D.MnO2+4HCl MnCl2+Cl2↑+2H2O MnCl2+Cl2↑+2H2O |
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与3.36 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
| A.120mL | B.60 mL | C.40 mL | D.30 mL |
下列变化中没有发生氧化还原反应的是
| A.金属冶炼 | B.SO2使品红溶液褪色 | C.钢铁锈蚀 | D.食物腐败 |