题目内容
用Pt电极电解含有Cu2+和X3+各0.1 mol 的溶液,阴极析出固体物质的质量m g与溶液中通过电子的物质的量n mol的关系如图。则离子的氧化能力由大到小排列正确的是( )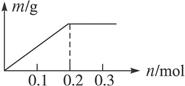
| A.Cu2+>X3+>H+ | B.H+>X3+>Cu2+ |
| C.Cu2+>H+>X3+ | D.X3+>H+>Cu2+ |
C
解析试题分析:根据阴极析出固体物质的质量与溶液中通过电子的物质的量的关系可知:首先是Cu2+发生反应,当Cu2+反应完全后,溶液中的金属阳离子并没有得到电子,发生氧化反应,可见应该是H+放电,所以离子的氧化能力由大到小排列正确的是Cu2+>H+>X3+,因此选项是C。
考点:考查溶液中离子放电能力大小比较的知识。

食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。已知:
氧化性:IO3->Fe3+>I2;还原性:S2O32->I-
3I2+6OH-=IO3-+5I-+3H2O;KI+I2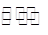 KI3
KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得试液分为3份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①加KSCN溶液后显红色,该红色物质是_____________(用化学式表示);CCl4中显紫红色的物质是___________(用电子式表示)。
②第二份试液中加入足量KI固体后,反应的离子方程式为_______________________________________、__________________________________________________________________。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。
写出潮湿环境下KI与氧气反应的化学方程式:_____________________。
将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适?___________ (填“是”或“否”),并说明理由_________________________________________________。
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是_______。
| A.Na2S2O3 | B.AlCl3 | C.Na2CO3 | D.NaNO2 |
某元素在化学反应中由化合态变为游离态,则该元素
| A.一定被氧化了 | B.一定被还原了 |
| C.既可能被还原也可能被氧化 | D.既不可能被氧化又不可能被还原 |
已知2MOyx-+5S2-+16H+=2M2++5S↓+8H2O,则MOyx-中的M的化合价为( )
| A.+3 | B.+4 | C.+6 | D.+7 |
向某FeBr2溶液中,通入1.12L(标准状况下)的Cl2,测得溶液中c(Br-)=3c
(Cl-)=0.3mol/L。反应过程中溶液的体积变化忽略不计,则下列说法中正确的是
| A.原溶液的浓度约为0.13mol/L | B.反应后溶液中c(Fe3+)=0.1mol/L |
| C.反应后溶液中c(Fe3+)=c(Fe2+) | D.原溶液中c(Br-)= 0.4mol/L |
“绿色化学”追求化工生产对环境零污染,下列物质中可以称为“绿色氧化剂”的是
| A.浓硫酸 | B.氯气 | C.双氧水 | D.漂白粉 |
矿石中金的含量很低,金的性质又相当稳定,只能用湿法冶金——氰化法提炼,即采用稀的NaCN溶液处理已粉碎的矿石,把少量的金浸入溶液中,然后用金属锌作还原剂将金从溶液中置换析出。其反应原理为
①4Au+8NaCN+O2+2H2O 4Na[Au(CN)2]+4NaOH;
4Na[Au(CN)2]+4NaOH;
②2Na[Au(CN)2]+Zn 2Au+Na2[Zn(CN)4]。
2Au+Na2[Zn(CN)4]。
以下有关氰化法提炼金的说法中正确的是
| A.Na[Au(CN)2]不溶于水 |
| B.化合物Na[Au(CN)2]中金元素的化合价为+1 |
| C.金元素在地壳中能以化合态的形式存在 |
| D.在提炼过程中含金元素的物质始终作氧化剂 |
 Cr2O72-
Cr2O72- Cr3+
Cr3+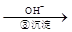 Cr(OH)3↓
Cr(OH)3↓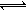 Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O