题目内容
2005年诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂。工业上冶炼钼的化学原理为:( )
①2MoS2+7O2=(高温)2MoO3+4SO2; ②MoO3+2NH3·H2O=(NH4)2MoO4+H2O;
③(NH4)2MoO4+2HCl=H2MoO4↓+2NH4Cl; ④H2MoO4=(△)MoO3+H2O;
⑤用还原剂将MoO3还原成金属钼。则下列说法正确的是
| A.MoS2煅烧产生的尾气可直接排入空气中 |
| B.MoO3是金属氧化物,也是碱性氧化物 |
| C.H2MoO4是一种强酸 |
| D.利用H2、CO和铝分别还原等量的MoO3,消耗还原剂的物质的量比为3:3:2 |
D
解析试题分析:A、从反应①看,MoS2煅烧后的产物中有SO2,它是大气污染物,因此尾气不能直接排入空气中,错误;B、碱性氧化物跟酸反应生成盐和水,但从反应②可看出,MoO3和碱反应生成盐和水,因此MoO3应该是酸性氧化物,又从反应③看,MoO3是H2MoO4的酸酐,因此不可能是碱性氧化物,错误;C、由③可知,强酸制弱酸,而且难溶液于水,错误;D、因为MoO3中钼元素显+6价,1molMoO3能得到6mol电子,而1molH2、CO、Al分别失去的电子数为2mol、2mol、3mol,根据电子守恒规律可知所消耗还原剂的物质的量之比为3:3:2,正确。
考点:本题考查化学流程的分析、基本概念、氧化还原反应原理。

练习册系列答案
 优等生题库系列答案
优等生题库系列答案
相关题目
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。有关说法不正确的是( )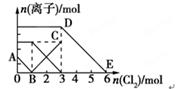
| A.线段BC代表Fe3+物质的量的变化情况 |
| B.原混合溶液中n(FeBr2)=3mol |
| C.当通入2molCl2时,溶液中已发生的离子反应为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
| D.原溶液中n(Fe2+):n(I-):n(Br-)=2∶1∶3 |
某元素在化学反应中由化合态变为游离态,则该元素
| A.一定被氧化了 | B.一定被还原了 |
| C.既可能被还原也可能被氧化 | D.既不可能被氧化又不可能被还原 |
试管内壁的硫磺可以用热的KOH溶液来洗涤:3S+6KOH==K2SO3+2K2S+3H2O,该反应中,被氧化与被还原的硫原子个数比为
| A.1:2 | B.2:1 | C.1:1 | D.3:2 |
下列过程中没有发生氧化还原反应的是
| A.天然气燃烧提供热量 |
| B.氯水使红色纸张褪色 |
| C.钢铁制品在空气中被腐蚀 |
| D.二氧化硫通人品红溶液中,溶液褪色 |
下列与化学概念有关的说法正确的是( )
| A.化合反应均为氧化还原反应 |
| B.催化剂能改变可逆反应达到平衡的时间 |
| C.金属氧化物均为碱性氧化物 |
| D.石油是混合物,其分馏产品汽油为纯净物 |

 Cu (HDZ)2+2H+,再加入CCl4、Cu (HDZ)2就很容易被萃取到CCl4中。
Cu (HDZ)2+2H+,再加入CCl4、Cu (HDZ)2就很容易被萃取到CCl4中。