题目内容
3.下列叙述正确的是( )| A. | 推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应 | |
| B. | 乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” | |
| C. | 用电解水的方法制取大量氢气可以缓解能源不足的问题 | |
| D. | 电解是把化学能转变成电能的过程 |
分析 A、根据温室效应的形成原因考虑:主要是由于释放出来的二氧化碳太多造成的,还与臭氧、甲烷等气体有关;
B、乙醇是可再生能源,汽油是化石燃料不是可再生能源;
C、电解水的方法制取大量H2,消耗大量电能;
D、电解是把电能转化为化学能.
解答 解:A、根据温室效应的形成原因考虑:主要是由于释放出来的二氧化碳太多造成的,还与臭氧、甲烷等气体有关;推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应,故A正确;
B、乙醇是可再生能源,汽油是化石燃料不是可再生能源,故B错误;
C、电解水的方法制取大量H2,消耗大量电能,不经济,故C错误;
D、把化学能转变成电能的装置是原电池,电解是把电能转化为化学能,故D错误;
故选A.
点评 本题考查了能源的使用和开发利用,温室气体效应的分析判断,电池的污染与回收,反应活化能的含义,题目难度中等.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案
相关题目
13.有四种短周期元素,它们的结构、性质等信息如下表所述:
请根据表中信息填写:
(1)X元素在周期表中的位置是第二周期第IVA族,其相对分子质量最小的气态氢化物的化学式是CH4.
(2)Y离子半径比Z离子的半径大(填“大”或“小”),Y元素的最高价氧化物的水化物和Z元素的最高价氧化物相互反应的离子方程式是:Al2O3+2OH-=2AlO2-+H2O.
(3)X与M两元素的气态氢化物的稳定性更强的是HCl(填化学式),请再举出一个实例比较M与X两元素的非金属性强弱(用化学方程式表示)Na2CO3+2HClO4=2NaClO4+CO2↑+H2O.
| 元素 | 结构、性质等信息 |
| X | 构成有机物的核心元素,该元素的一种氧化物和气态氢化物都是典型的温室气体 |
| Y | 短周期中(除稀有气体外)原子半径最大的元素,该单质液态时可用作核反应堆的传热介质 |
| Z | 与Y同周期,其最高价氧化物的水化物呈两性 |
| M | 海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
(1)X元素在周期表中的位置是第二周期第IVA族,其相对分子质量最小的气态氢化物的化学式是CH4.
(2)Y离子半径比Z离子的半径大(填“大”或“小”),Y元素的最高价氧化物的水化物和Z元素的最高价氧化物相互反应的离子方程式是:Al2O3+2OH-=2AlO2-+H2O.
(3)X与M两元素的气态氢化物的稳定性更强的是HCl(填化学式),请再举出一个实例比较M与X两元素的非金属性强弱(用化学方程式表示)Na2CO3+2HClO4=2NaClO4+CO2↑+H2O.
18.下列一组粒子的中心原子杂化类型相同,分子或离子的键角不相等的是( )
| A. | CCl4、SiCl4、SiH4 | B. | H2S、NF3、CH4 | ||
| C. | BCl3、CH2═CHCl、环己烷 | D. | SO3、C6H6(苯)、CH3C≡CH |
8.水溶液中能大量共存的一组离子是( )
| A. | pH=1的溶液中:Fe2+、CH3COO-、K+、SO42- | |
| B. | 在含较多Al3+的溶液中:Na+、Cl-、HCO3- | |
| C. | 在0.1 mol•L-1 CaCl2溶液中:K+、Ba2+、I-、OH- | |
| D. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=10-12的溶液中:K+、Na+、ClO-、NO${\;}_{3}^{-}$ |
15.化学广泛应用于生活生产,下列说法正确的是( )
| A. | 青铜器、硬币都属于纯净物 | |
| B. | 葡萄糖和银氨溶液发生银镜反应可用作制镜子 | |
| C. | 铺路用的沥青主要含有C、H、O等元素 | |
| D. | 鸡蛋清中加入胆矾可以使蛋白质发生盐析 |
14.A、B、C、D为四种主族元素,A、B元素的阳离子和C、D元素的阴离子都具有相同的电子层结构,且A的阳离子的氧化性比B的阳离子的氧化性弱,C的阴离子所带的负电荷比D的阴离子所带的负电荷多,则它们的原子半径由大至小的顺序是( )
| A. | D>C>B>A | B. | A>B>C>D | C. | B>A>C>D | D. | A>B>D>C |





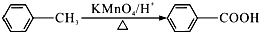
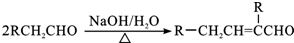
 .
. .
. 或
或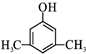 (写出其中一种的结构简式).
(写出其中一种的结构简式).