题目内容
13.有四种短周期元素,它们的结构、性质等信息如下表所述:| 元素 | 结构、性质等信息 |
| X | 构成有机物的核心元素,该元素的一种氧化物和气态氢化物都是典型的温室气体 |
| Y | 短周期中(除稀有气体外)原子半径最大的元素,该单质液态时可用作核反应堆的传热介质 |
| Z | 与Y同周期,其最高价氧化物的水化物呈两性 |
| M | 海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
(1)X元素在周期表中的位置是第二周期第IVA族,其相对分子质量最小的气态氢化物的化学式是CH4.
(2)Y离子半径比Z离子的半径大(填“大”或“小”),Y元素的最高价氧化物的水化物和Z元素的最高价氧化物相互反应的离子方程式是:Al2O3+2OH-=2AlO2-+H2O.
(3)X与M两元素的气态氢化物的稳定性更强的是HCl(填化学式),请再举出一个实例比较M与X两元素的非金属性强弱(用化学方程式表示)Na2CO3+2HClO4=2NaClO4+CO2↑+H2O.
分析 短周期元素中,X元素是构成有机物的核心元素,该元素的一种氧化物和气态氢化物都是典型的温室气体,故X为C元素;Y是短周期中(除稀有气体外)原子半径最大的元素,该单质液态时可用作核反应堆的传热介质,故Y为Na;Z与Y同周期,其最高价氧化物的水化物呈两性,故Z为Al;M是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂,则M为Cl.
(1)主族元素周期数=电子层数、主族族序数=最外层电子数,碳元素相对分子质量最小的气态氢化物为甲烷;
(2)Na+、Al3+离子电子层结构相同,核电荷数越大离子半径越小;Y元素的最高价氧化物的水化物为NaOH,Z元素的最高价氧化物为Al2O3,二者反应生成偏铝酸钠与水;
(3)非金属性越强,氢化物越稳定,可以利用最高价含氧酸的酸性强弱进行比较.
解答 解:短周期元素中,X元素是构成有机物的核心元素,该元素的一种氧化物和气态氢化物都是典型的温室气体,故X为C元素;Y是短周期中(除稀有气体外)原子半径最大的元素,该单质液态时可用作核反应堆的传热介质,故Y为Na;Z与Y同周期,其最高价氧化物的水化物呈两性,故Z为Al;M是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂,则M为Cl.
(1)X为碳元素,处于周期表中第二周期第IVA族,其相对分子质量最小的气态氢化物的化学式是CH4,
故答案为:第二周期第IVA族;CH4;
(2)Na+、Al3+离子电子层结构相同,核电荷数越大离子半径越小,故离子半径:Na+>Al3+,Y元素的最高价氧化物的水化物为NaOH,Z元素的最高价氧化物为Al2O3,反应离子方程式为:Al2O3+2OH-=2AlO2-+H2O,
故答案为:大;Al2O3+2OH-=2AlO2-+H2O;
(3)由于非金属性C<Cl,故氢化物稳定性CH4<HCl,用化学方程式表示M与X两元素的非金属性强弱:
Na2CO3+2HClO4=2NaClO4+CO2↑+H2O,
故答案为:HCl;Na2CO3+2HClO4=2NaClO4+CO2↑+H2O.
点评 本题考查结构性质位置关系应用,比较基础,注意掌握金属性、非金属性强弱比较实验事实.

 名校课堂系列答案
名校课堂系列答案| A. | CH3CH2CHO | B. | 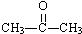 | C. | CH2=CHCOOH | D. | CH3COOCH3 |
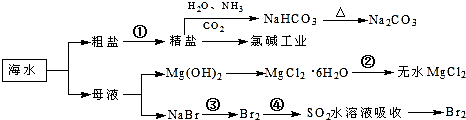
下列有关说法正确的是( )
| A. | 过程①中除去粗盐中的SO、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 步骤④的作用是达到富集溴的目的 | |
| C. | 过程②中MgCl2•6H2O加热脱水制得无水MgCl2 | |
| D. | 工业上电解熔融精盐的过程称为氯碱工业 |
| A. | 5.6g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA | |
| B. | 12.5mL 16mol.L-1浓硫酸与足量铜反应,转移电子数为0.2NA | |
| C. | 7.8g Na 2S和Na2O2 的混合物中含有的阴离子数等于0.1NA | |
| D. | 0.5mol氧单质含有NA个O2 |
| A. | 推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应 | |
| B. | 乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” | |
| C. | 用电解水的方法制取大量氢气可以缓解能源不足的问题 | |
| D. | 电解是把化学能转变成电能的过程 |
