题目内容
11.将过量的两份锌粉a、b中分别加入少量且等量的稀硫酸溶液中,同时向a中加入少量的CuSO4溶液,下列各图表示的是产生H2的体积V与时间t的关系,其中正确的是( )| A. |  | B. | 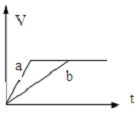 | C. | 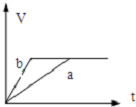 | D. | 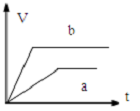 |
分析 反应均发生Zn+2H+═Zn2++H2↑,Zn过量,则等浓度、等体积的稀硫酸完全反应,生成氢气相同,且a中加入少量CuSO4溶液,构成Cu、Zn原电池,加快反应的速率,以此来解答.
解答 解:由题意可知,反应均发生Zn+2H+═Zn2++H2↑,Zn过量,则等浓度、等体积的稀硫酸完全反应,生成氢气相同,且a中加入少量CuSO4溶液,构成Cu、Zn原电池,加快反应的速率,所以a反应速率快,达到反应结束时的时间短,显然只有B图象符合,
故选B.
点评 本题考查影响化学反应速率的因素,注意原电池加快反应速率及Fe过量是解答本题的关键,明确图象中线的意义即可解答,题目难度中等.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
19.A、B两种有机化合物,当混合物总质量一定时,无论A、B以何种比例混合,完全燃烧时产生的CO2的量均相等,肯定符合上述条件的可能是( )
①同分异构体;
②具有相同的最简式;
③同系物;
④含碳的质量分数相同.
①同分异构体;
②具有相同的最简式;
③同系物;
④含碳的质量分数相同.
| A. | ①③ | B. | ①②④ | C. | ①②③④ | D. | ①③④ |
3.下列叙述正确的是( )
| A. | 推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应 | |
| B. | 乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” | |
| C. | 用电解水的方法制取大量氢气可以缓解能源不足的问题 | |
| D. | 电解是把化学能转变成电能的过程 |
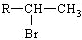 (R为烃基)
(R为烃基)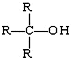 不能发生催化氧化反应.
不能发生催化氧化反应. ;该元素位于第三周期,第ⅢA族.
;该元素位于第三周期,第ⅢA族.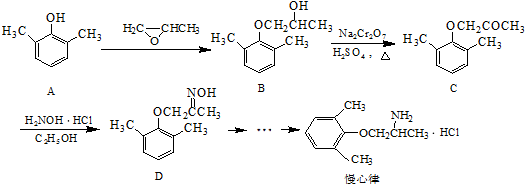
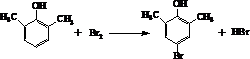 .
.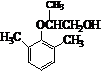 .
.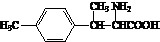 .
.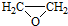 ).写出以邻甲基苯
).写出以邻甲基苯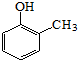 )和乙醇为原料制备
)和乙醇为原料制备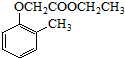 的合成路线流程图(无机试
的合成路线流程图(无机试
 .
.