题目内容
18.下列一组粒子的中心原子杂化类型相同,分子或离子的键角不相等的是( )| A. | CCl4、SiCl4、SiH4 | B. | H2S、NF3、CH4 | ||
| C. | BCl3、CH2═CHCl、环己烷 | D. | SO3、C6H6(苯)、CH3C≡CH |
分析 根据价电子对互斥理论确定微粒的空间构型和原子的杂化方式,价层电子对个数=σ键个数+孤电子对个数.σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数,
A.中心原子都是sp3杂化,其键角相同;
B.中心原子都是sp3杂化,但孤电子对数不同,分子的键角不相同;
C.BCl3和CH2═CHCl的中心原子都是sp2杂化,环己烷中碳原子为sp3杂化,分子的键角不相同;
D.SO3和C6H6的中心原子为sp2杂化,而CH3C≡CH中碳原子为sp和sp3杂化,分子的键角不相同.
解答 解:A.CCl4中C原子杂化轨道数=σ键数+孤对电子对数=4+0=4,所以采取sp3杂化,SiCl4中C原子杂化轨道数=σ键数+孤对电子对数=4+0=4,所以采取sp3杂化,SiH4中C原子杂化轨道数=σ键数+孤对电子对数=4+0=4,所以采取sp3杂化,中心原子都是sp3杂化,其键角相同,故A错误;
B.H2S中S原子杂化轨道数=σ键数+孤对电子对数=2+$\frac{6-2}{2}$=4,所以采取sp3杂化,分子构型为V型,NF3中氮原子杂化轨道数=σ键数+孤对电子对数=3+$\frac{5-3}{2}$=4,所以采取sp3杂化,分子构型为四面体型,CH4中C原子杂化轨道数=δ键数+孤对电子对数=4+0=4,所以采取sp3杂化,分子构型为正四面体型,中心原子都是sp3杂化,孤电子对数不同,分子的键角不相同,故B正确;
C.BCl3中B原子杂化轨道数=σ键数+孤对电子对数=3+0=3,sp2杂化,分子的立体构型为平面三角形,氯乙烯分子中每个碳原子杂化轨道数为3,所以采取sp2杂化,BCl3和CH2═CHCl的中心原子都是sp2杂化,环己烷中碳原子杂化轨道数=σ键数+孤对电子对数=4+0=4,为sp3杂化,BCl3、CH2═CHCl、环已烷中心原子杂化类型不相同,分子或离子的键角不相等,故C错误;
D.SO3中,价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(6-3×2)=3,含孤电子对数为0,杂化轨道数3,硫原子采用sp2杂化,分子形状为平面三角形;苯中碳原子杂化轨道数为3,所以采取sp2杂化,丙炔中含有4个C-H键,两个C-C键,两个π键,即C≡N中含有1个σ键和2个π键,甲基采取sp3杂化,C≡C中的碳为sp杂化,中心原子杂化类型不相同,分子或离子的键角不相等,故D错误;
故选B.
点评 本题主要考查了原子的杂化、分子的空间构型等知识,为高频考点,注意孤电子对的确定以及原子杂化理论的应用为解答关键,题目难度中等.

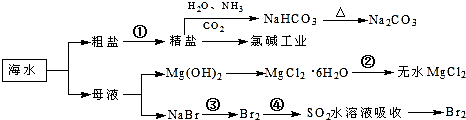
下列有关说法正确的是( )
| A. | 过程①中除去粗盐中的SO、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 步骤④的作用是达到富集溴的目的 | |
| C. | 过程②中MgCl2•6H2O加热脱水制得无水MgCl2 | |
| D. | 工业上电解熔融精盐的过程称为氯碱工业 |
| A. | 推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应 | |
| B. | 乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” | |
| C. | 用电解水的方法制取大量氢气可以缓解能源不足的问题 | |
| D. | 电解是把化学能转变成电能的过程 |
| A. | 17gNH3含有10nA个质子 | |
| B. | 标准状况下,22.4L氯水含有nA个Cl2分子 | |
| C. | 1mol C2H6含有6nA个共价键 | |
| D. | 1mol 金属K被完全氧化生成KO2,失去2nA个电子 |
| A. | 滴定管和容量瓶在使用前均需检查是否漏水 | |
| B. | 用蒸馏水湿润的pH试纸测定溶液的pH | |
| C. | 托盘天平称量药品时,都应垫上滤纸称量 | |
| D. | 石蕊、酚酞均可用作中和滴定的指示剂 |

 (R为烃基)
(R为烃基) 不能发生催化氧化反应.
不能发生催化氧化反应.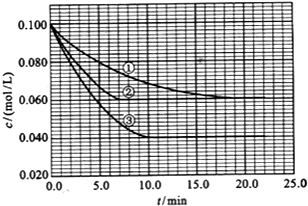 在溶液中,反应A(g)+2B(g)?C(g)分别在三种不同实验条件下进行,它们的起始浓度均为 c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.请回答下列问题:
在溶液中,反应A(g)+2B(g)?C(g)分别在三种不同实验条件下进行,它们的起始浓度均为 c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.请回答下列问题: 如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是( )
如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是( )