题目内容
14.已知在Ca3(PO4)2的饱和溶液中存在平衡:Ca3(PO4)2(s)?3Ca2+(aq)+2PO${\;}_{4}^{3-}$(aq)(1)溶度积Ksp=C3(Ca2+)•C2(PO43-);
(2)若一定温度下,饱和溶液中c(Ca2+)=2.0×10-6 mol•L-1,c(PO${\;}_{4}^{3-}$)=1.58×10-6 mol•L-1,则Ksp=2.0×10-29.
分析 (1)依据平衡Ca3(PO4)2(s)?3Ca2+(aq)+2PO43-(aq),得出Ksp[Ca3(PO4)2]=[c(Ca2+)]3×[c(PO43-)]2;
(2)依据Ksp[Ca3(PO4)2]=[c(Ca2+)]3×[c(PO43-)]2计算即可.
解答 解:(1)Ca3(PO4)2(s)?3Ca2+(aq)+2PO43-(aq),故Ksp=C3(Ca2+)•C2(PO43-),故答案为:C3(Ca2+)•C2(PO43-);
(2)Ksp=C3(Ca2+)•C2(PO43-)=(2.0×10-6 mol•L-1)3×(1.58×10-6 mol•L-1)2=2.0×10-29,故答案为:2.0×10-29.
点评 本题主要考查了沉淀溶解平衡常数的不等式以及溶度积的计算,题目难度不大.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
19.A、B两种有机化合物,当混合物总质量一定时,无论A、B以何种比例混合,完全燃烧时产生的CO2的量均相等,肯定符合上述条件的可能是( )
①同分异构体;
②具有相同的最简式;
③同系物;
④含碳的质量分数相同.
①同分异构体;
②具有相同的最简式;
③同系物;
④含碳的质量分数相同.
| A. | ①③ | B. | ①②④ | C. | ①②③④ | D. | ①③④ |
3.下列叙述正确的是( )
| A. | 推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应 | |
| B. | 乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” | |
| C. | 用电解水的方法制取大量氢气可以缓解能源不足的问题 | |
| D. | 电解是把化学能转变成电能的过程 |
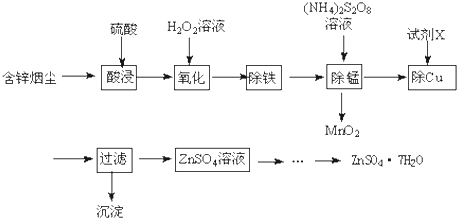
5.将“废杂铜烟尘”用硫酸吸收浸取,既可保护环境又可得到用途广泛的高纯硫酸锌.已知烟尘中主要含ZnO,还有少量的FeO、Fe2O3、CuO、MnO.制备工艺流程如图:
(1)硫酸锌溶液滴入石蕊试液,溶液变红,其原因是Zn2+水解使溶液显酸性,Zn2++2H2O?Zn(OH)2+2H+.
(2)H2O2氧化Fe2+的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)“除铁”时,溶液的pH应调整到3.2~5.2(相关金属离子生成氢氧化物沉淀的pH及沉淀完全的pH,金属离子开始沉淀时的浓度为1mol•L-1).
(4)“除锰”时溶液中发生反应的化学方程式为MnSO4+(NH4)2S2O8+2H2O=MnO2↓+(NH4)2SO4+2H2SO4或MnSO4+(NH4)2S2O8+2H2O=MnO2↓+2NH4HSO4+H2SO4.
(5)试剂X为Zn粉.
(6)由ZnSO4溶液需经过:蒸发浓缩、冷却结晶、过滤及干燥得ZnSO4•7H2O.
(1)硫酸锌溶液滴入石蕊试液,溶液变红,其原因是Zn2+水解使溶液显酸性,Zn2++2H2O?Zn(OH)2+2H+.
(2)H2O2氧化Fe2+的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)“除铁”时,溶液的pH应调整到3.2~5.2(相关金属离子生成氢氧化物沉淀的pH及沉淀完全的pH,金属离子开始沉淀时的浓度为1mol•L-1).
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Zn2+ | 5.5 | 8.0 |
| Cu2+ | 5.2 | 6.7 |
| Fe2+ | 5.8 | 8.8 |
(5)试剂X为Zn粉.
(6)由ZnSO4溶液需经过:蒸发浓缩、冷却结晶、过滤及干燥得ZnSO4•7H2O.



 (R为烃基)
(R为烃基) 不能发生催化氧化反应.
不能发生催化氧化反应.