题目内容
14.A、B、C、D为四种主族元素,A、B元素的阳离子和C、D元素的阴离子都具有相同的电子层结构,且A的阳离子的氧化性比B的阳离子的氧化性弱,C的阴离子所带的负电荷比D的阴离子所带的负电荷多,则它们的原子半径由大至小的顺序是( )| A. | D>C>B>A | B. | A>B>C>D | C. | B>A>C>D | D. | A>B>D>C |
分析 A、B、C、D为四种主族元素,A、B元素的阳离子和C、D元素的阴离子都具有相同的电子层结构,则A、B同周期,C、D同周期,且A、B处于C、D的下一周期,A的阳离子的氧化性比B的阳离子的氧化性弱,则金属性A>B,原子序数A<B,C的阴离子所带的负电荷比D的阴离子所带的负电荷多,则原子序数C<D,同周期自左而右原子半径减小、同主族自上而下原子半径增大.
解答 解:A、B、C、D为四种主族元素,A、B元素的阳离子和C、D元素的阴离子都具有相同的电子层结构,则A、B同周期,C、D同周期,且A、B处于C、D的下一周期,A的阳离子的氧化性比B的阳离子的氧化性弱,则金属性A>B,原子序数A<B,C的阴离子所带的负电荷比D的阴离子所带的负电荷多,则原子序数C<D,同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:A>B>C>D,
故选B.
点评 本题考查原子结构与元素周期律,关键是明确元素相对位置,再结合元素周期律解答,A、B、C、D四种元素可假设为K、Ca、S、Cl,对解析具体问题更加直观.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.下列叙述正确的是( )
| A. | 推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应 | |
| B. | 乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” | |
| C. | 用电解水的方法制取大量氢气可以缓解能源不足的问题 | |
| D. | 电解是把化学能转变成电能的过程 |
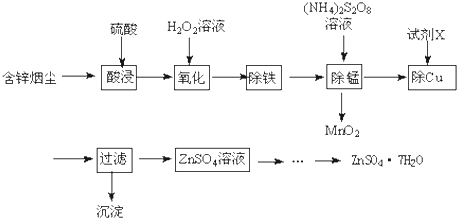
5.将“废杂铜烟尘”用硫酸吸收浸取,既可保护环境又可得到用途广泛的高纯硫酸锌.已知烟尘中主要含ZnO,还有少量的FeO、Fe2O3、CuO、MnO.制备工艺流程如图:
(1)硫酸锌溶液滴入石蕊试液,溶液变红,其原因是Zn2+水解使溶液显酸性,Zn2++2H2O?Zn(OH)2+2H+.
(2)H2O2氧化Fe2+的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)“除铁”时,溶液的pH应调整到3.2~5.2(相关金属离子生成氢氧化物沉淀的pH及沉淀完全的pH,金属离子开始沉淀时的浓度为1mol•L-1).
(4)“除锰”时溶液中发生反应的化学方程式为MnSO4+(NH4)2S2O8+2H2O=MnO2↓+(NH4)2SO4+2H2SO4或MnSO4+(NH4)2S2O8+2H2O=MnO2↓+2NH4HSO4+H2SO4.
(5)试剂X为Zn粉.
(6)由ZnSO4溶液需经过:蒸发浓缩、冷却结晶、过滤及干燥得ZnSO4•7H2O.
(1)硫酸锌溶液滴入石蕊试液,溶液变红,其原因是Zn2+水解使溶液显酸性,Zn2++2H2O?Zn(OH)2+2H+.
(2)H2O2氧化Fe2+的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)“除铁”时,溶液的pH应调整到3.2~5.2(相关金属离子生成氢氧化物沉淀的pH及沉淀完全的pH,金属离子开始沉淀时的浓度为1mol•L-1).
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Zn2+ | 5.5 | 8.0 |
| Cu2+ | 5.2 | 6.7 |
| Fe2+ | 5.8 | 8.8 |
(5)试剂X为Zn粉.
(6)由ZnSO4溶液需经过:蒸发浓缩、冷却结晶、过滤及干燥得ZnSO4•7H2O.

9. 如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是( )
如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是( )
①X的气态氢化物与Y的最高价氧化物对应的水化物能发生反应生成盐
②Y、Z的气态氢化物水溶液的均显酸性
③Z的单质在常温下是液体
④Z的原子序数比Y大19
⑤Z所在的周期中含有32种元素.
 如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是( )
如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是( )①X的气态氢化物与Y的最高价氧化物对应的水化物能发生反应生成盐
②Y、Z的气态氢化物水溶液的均显酸性
③Z的单质在常温下是液体
④Z的原子序数比Y大19
⑤Z所在的周期中含有32种元素.
| A. | ①②③④ | B. | ①②③④⑤ | C. | 只有③ | D. | 只有①④ |
19.下列化学反应既属于氧化还原反应又属于吸热反应的是( )
| A. | 铝片和稀盐酸反应 | B. | 氢氧化钡晶体和氯化铵反应 | ||
| C. | 灼热的碳与CO2反应 | D. | 甲烷在氧气中燃烧 |
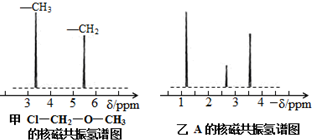
6.研究有机物一般经过以下几个基本步骤:分离、提纯→确定实验式→确定分子式→确定结构式以下用于研究有机物的方法错误的是( )
| A. | 蒸馏常用于分离提纯液态有机混合物 | |
| B. | 燃烧法是确定有机物成分的有效方法之一 | |
| C. | 红外光谱通常用于分析有机物的相对分子质量 | |
| D. | 核磁共振氢谱的研究有助于确定有机物分子中氢原子的类型和数目比 |
 .
.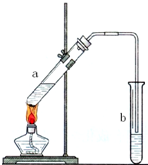 可用图示装置制取少量乙酸乙酯.已知乙酸乙酯的沸点低于乙醇.请填空:
可用图示装置制取少量乙酸乙酯.已知乙酸乙酯的沸点低于乙醇.请填空: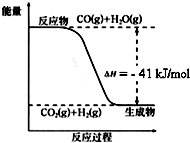 已知工业制氢气的反应为CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中能量变化如图所示.在500℃时的平衡常数 K=9.若在2L的密闭容器中CO和水蒸气的起始浓度都是0.1mol/L,10min时达到平衡状态.
已知工业制氢气的反应为CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中能量变化如图所示.在500℃时的平衡常数 K=9.若在2L的密闭容器中CO和水蒸气的起始浓度都是0.1mol/L,10min时达到平衡状态.