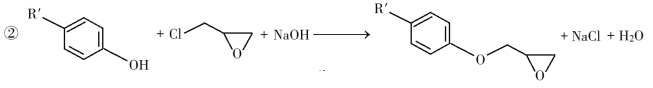
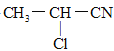题目内容
【题目】![]() 时,配制一组
时,配制一组![]() 的混合溶液,溶液中
的混合溶液,溶液中![]() 、
、![]() 、
、![]() 、
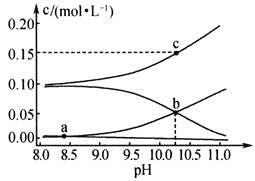
、![]() 的浓度与溶液pH的关系曲线如下图所示。下列说法正确的是
的浓度与溶液pH的关系曲线如下图所示。下列说法正确的是
A.该温度下,![]() 的电离平衡常数
的电离平衡常数![]()
B.a点:![]()
C.b点:![]()
D.向c点所表示的溶液中滴加等体积![]() 的NaOH溶液:
的NaOH溶液:![]()
【答案】D
【解析】
c (Na2CO3) +c (NaHCO3) =0. 10molL-1的混合溶液中,钠离子浓度最大,且碱性越强时CO32-越大,HCO3-、H2CO3均随pH增大而减小,则图中c在Na+的浓度变化曲线上,a在H2CO3、CO32-的浓度变化曲线上、b在HCO3-的浓度变化曲线上;
A. Ka1=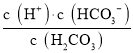 ,图中数据不能确定碳酸的浓度,则不能计算H2CO3的电离平衡常数Ka1,可由b点计算H2CO3的电离平衡常数Ka2,故A错误;
,图中数据不能确定碳酸的浓度,则不能计算H2CO3的电离平衡常数Ka1,可由b点计算H2CO3的电离平衡常数Ka2,故A错误;
B. a点溶液遵循电荷守恒c (HCO3-) +2c (CO32-) +c (OH-) =c (Na+) +c(H+),且a点时c (H2CO3) =c (CO32-) ,则a点: c (Na+) +c (H+) =c(OH-) +c (HCO3-) +2c (H2CO3) ,故B错误;
C. b点时c (HCO3-) =c (CO32-) ,c (Na+) =0.15 molL-1,物料守恒式为:c(H2CO3) +c (HCO3-) +c (CO32-) =0.1 molL-1,则b点:c (Na+) +c (H2CO3) =0.10 molL-1+c (CO32-) ,故C错误;
D. c点时Na+的浓度为0.15 molL-1,c (Na2CO3) +c (NaHCO3) =0.10molL-1,则c(Na2CO3) =0.05 molL-1,c (NaHCO3) =0.05 molL-1,滴加等体积0.05 molL-1的NaOH溶液,与NaHCO3恰好反应生成Na2CO3,由溶液中质子守恒可知c (OH-) =c (HCO3-) +c (H+) +2c (H2CO3),故D正确;
答案选D。

【题目】丙烯酸是合成丙烯酸脂的原料,丙烯醇用于生产甘油、塑料等。某小组以丙烯醛为原料生产丙烯醇、丙烯酸的流程如图所示:
 已知反应原理:
已知反应原理:![]()
![]()
有关物质的物理性质如表:
| 丙烯醛 | 丙烯醇 | 丙烯酸 | 四氯化碳 |
沸点/℃ | 53 | 97 | 141 | 77 |
熔点/℃ | -87 | -129 | 13 | -22.8 |
密度/gcm-3 | 0.84 | 0.85 | 1.02 | 1.58 |
溶解性(常温) | 易溶于水和 有机物 | 溶于水和 有机溶剂 | 溶于水和 有机溶剂 | 难溶于水, 易溶于有机物 |
(1)已知苯的沸点为80.1℃,上述步骤②的萃取剂用四氯化碳而不用苯,其主要原因可能是_________________。上层液体分液漏斗________(填“上”或“下”)口倒(或放)出。
(2)从步骤④的残留液中可提取一种无水正盐,它是________(填化学式)。
(3)步骤⑤采用如图装置,该装置有一处明显错误,请指出错误:________,并改之。收集丙烯醇的温度应控制在________左右。

(4)已知:醛类具有较强还原性,能与溴水、酸性高锰酸钾溶液、银氨溶液等反应。某同学为了证明丙烯酸产品中含有丙烯醛,设计如下方案:
a.取少量溴水于试管,加入适量丙烯酸样品,振荡,溶液褪色
b.取少量酸性高锰酸钾溶液于试管,加入适量丙烯酸样品,振荡,溶液褪色
c.取少量银氨溶液于试管,加入适量丙烯酸样品,用水浴加热,有银镜产生
d.取少量酸性重铬酸钾溶液于试管,加入适量丙烯酸样品,振荡,溶液由橙红色变成绿色
上述方案中,能证明丙烯酸产品中含少量丙烯醛的是________(填字母)。
(6)为了证明丙烯酸是弱酸,设计如下方案,其中能达到实验目的的是________(填字母)。
代号 | 方案 | 预测现象 |
A | 取少量 | 溶液变红色 |
B | 常温下,将10ml0.1molL-1NaOH溶液和10ml0.1molL-1 | pH>7 |
C | 用相同的导电仪分别测定盐酸溶液、 | 前者灯泡较亮 |