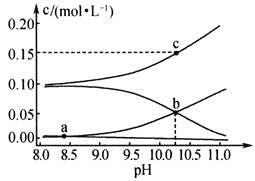
题目内容
【题目】丙烯酸是合成丙烯酸脂的原料,丙烯醇用于生产甘油、塑料等。某小组以丙烯醛为原料生产丙烯醇、丙烯酸的流程如图所示:
 已知反应原理:
已知反应原理:![]()
![]()
有关物质的物理性质如表:
| 丙烯醛 | 丙烯醇 | 丙烯酸 | 四氯化碳 |
沸点/℃ | 53 | 97 | 141 | 77 |
熔点/℃ | -87 | -129 | 13 | -22.8 |
密度/gcm-3 | 0.84 | 0.85 | 1.02 | 1.58 |
溶解性(常温) | 易溶于水和 有机物 | 溶于水和 有机溶剂 | 溶于水和 有机溶剂 | 难溶于水, 易溶于有机物 |
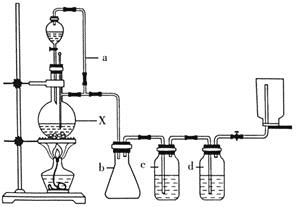
(1)已知苯的沸点为80.1℃,上述步骤②的萃取剂用四氯化碳而不用苯,其主要原因可能是_________________。上层液体分液漏斗________(填“上”或“下”)口倒(或放)出。
(2)从步骤④的残留液中可提取一种无水正盐,它是________(填化学式)。
(3)步骤⑤采用如图装置,该装置有一处明显错误,请指出错误:________,并改之。收集丙烯醇的温度应控制在________左右。

(4)已知:醛类具有较强还原性,能与溴水、酸性高锰酸钾溶液、银氨溶液等反应。某同学为了证明丙烯酸产品中含有丙烯醛,设计如下方案:
a.取少量溴水于试管,加入适量丙烯酸样品,振荡,溶液褪色
b.取少量酸性高锰酸钾溶液于试管,加入适量丙烯酸样品,振荡,溶液褪色
c.取少量银氨溶液于试管,加入适量丙烯酸样品,用水浴加热,有银镜产生
d.取少量酸性重铬酸钾溶液于试管,加入适量丙烯酸样品,振荡,溶液由橙红色变成绿色
上述方案中,能证明丙烯酸产品中含少量丙烯醛的是________(填字母)。
(6)为了证明丙烯酸是弱酸,设计如下方案,其中能达到实验目的的是________(填字母)。
代号 | 方案 | 预测现象 |
A | 取少量 | 溶液变红色 |
B | 常温下,将10ml0.1molL-1NaOH溶液和10ml0.1molL-1 | pH>7 |
C | 用相同的导电仪分别测定盐酸溶液、 | 前者灯泡较亮 |
【答案】苯、丙烯醇的沸点差小于四氯化碳和丙烯醇的沸点差 上 Na2SO4 温度计的水银球不应插入液面下 97℃ c 取少量溴的四氯化碳溶液于试管,滴加丙烯醇,振荡,溶液褪色,则丙烯醇含碳碳双键 B
【解析】
(1)利用蒸馏操作分离液体混合物,液体沸点相差越大,分离效果越好;分液时下层液体从下口放出,上层液体从上口倒出;
(2)第①步加入NaOH,第③步中加入了稀硫酸,稀硫酸可与NaOH发生反应;
(3)温度计测量的是蒸气的温度;丙烯醇的沸点为97℃,在沸点附近收集;
(4)醛类具有较强还原性,能与溴水、酸性高锰酸钾溶液、银氨溶液等反应,可利用银镜反应判断丙烯酸产品中含是否有丙烯醛;
(5)利用碳碳双键能与溴的四氯化碳溶液发生加成反应而使溶液褪色证明丙烯醇含有碳碳双键;
(6)方案A:只能证明丙烯酸水溶液呈酸性,不能证明它是弱酸;
方案B:二者恰好完全反应,盐溶液呈碱性,说明它是弱酸;
方案C:未说明浓度,不能证明丙烯酸是弱酸;
(1)利用蒸馏操作分离液体混合物,液体沸点相差越大,分离效果越好,苯与丙烯醇的沸点较四氯化碳小,分离不充分;分液操作中,上层液体从上口倒出;
(2)先加入氢氧化钠溶液,后加入稀硫酸,可从废液中提取硫酸钠;
(3)蒸馏操作中,温度计测定蒸气温度,水银球与蒸馏烧瓶支管口下沿相平,丙烯醇的沸点温度就是收集丙烯醇的馏分温度,即收集丙烯醇的温度应控制在97℃左右;
(4)检验丙烯醛中醛基,碳碳双键会干扰,应选择银氨溶液检验醛基;
答案选c;
(5)检验丙烯醇中碳碳双键要排除-CH2OH干扰,酸性高锰酸钾溶液、酸性重铬酸钾溶液能氧化羟基、故选择溴的四氯化碳溶液检验碳碳双键,操作方法为:取少量溴的四氧化碳溶液于试管,滴加丙烯醇,振荡,溶液褪色,则丙烯醇含碳碳双键;
(6)方案A:只能证明丙烯酸水溶液呈酸性,不能证明它是弱酸;
方案B:二者恰好完全反应,盐溶液呈碱性,说明它是弱酸;
方案C:未说明浓度,不能证明丙烯酸是弱酸;
答案选B。

【题目】三氯胺(NCl3)是一种饮用水二级消毒剂,可由以下反应制备:
Ⅰ.![]()
![]()
回答下列问题:
(1)已知:Ⅱ.![]()
![]()
Ⅲ.![]()
![]()
则![]() =________(用含
=________(用含![]() 和
和![]() 的代数式表示)。
的代数式表示)。
(2)向容积均为2L的甲乙两个恒温密闭容器中分别加入4mol NH3和4mol Cl2,发生反应Ⅰ,测得两容器中n(Cl2)随反应时间的变化情况如下表所示:
时间/min | 0 | 40 | 80 | 120 | 160 |
容器甲(T1) | 4.0 | 3.0 | 2.2 | 1.6 | 1.6 |
容器乙(T2) | 4.0 | 2.9 | 2.0 | 2.0 | 2.0 |
①0~80min内,容器甲中v(NH3)=________________。
②反应Ⅰ的![]() ________0(填“>”或“<”),其原因为________________________。
________0(填“>”或“<”),其原因为________________________。
③关于容器乙,下列说法正确的是________
A.容器内![]() ,说明反应达到平衡状态
,说明反应达到平衡状态
B.反应进行到70min时,v正一定大于v逆
C.容器内气体平均相对分子质量在增大,说明平衡在正向移动
D.达平衡后,加入一定量NCl3(l),平衡逆向移动
E.达平衡后,按原投料比再充入一定量反应物,平衡后NH3的转化率增大
④温度为T1时HCl(g)的平衡体积分数=________,该温度下,若改为初始体积为2L的恒压容器,平衡时容器中n(Cl2)________(填“>”、“=”或“<”)1.6mol。
⑤温度为T2时,该反应的平衡常数K=________。
【题目】(1)将一定量的N2(g)和H2(g)放入2L的密闭容器中,在500℃、2×107Pa下发生如下反应:N2(g)+3H2(g) ![]() 2NH3(g)
2NH3(g)
①在反应体系中加入催化剂,该反应的反应热_____(填“增大”、“减小”或“不变”)。
②5分钟后达到平衡,测得N2为0.2 mol,H2为0.6 mol,NH3为0.2 mol。氮气的平均反应速率υ(N2)=___________,H2的转化率为_____________(保留小数点后一位)。
③欲提高②容器中H2的转化率,下列措施可行的是____________。
a.把气体的体积压缩至1L b.向容器中再充入惰性气体
c.改变反应的催化剂 d.液化生成物分离出氨
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应:2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g) ΔH=akJ/mol,进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
4NH3(g)+3O2(g) ΔH=akJ/mol,进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
T/K | 303 | 313 | 323 |
NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
此合成反应的a_________0。(填“大于”、“小于”或“等于”)
【题目】以硅藻土为载体的五氧化二钒![]() 是接触法生成硫酸的催化剂。从废钒催化剂中回收
是接触法生成硫酸的催化剂。从废钒催化剂中回收![]() 既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 |
|
|
|
|
|
|
质量分数 |
|
|
|
|
|
|
如图1是一种废钒催化剂回收工艺路线:
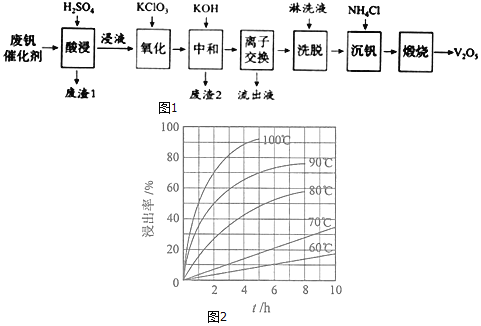
回答下列问题:
(1)“酸浸”时![]() 转化为
转化为![]() ,反应的离子方程式为______,同时
,反应的离子方程式为______,同时![]() 转成
转成![]() 为提高浸出速率,除适当增加硫酸浓度浓度外,还可采取的措施有______
为提高浸出速率,除适当增加硫酸浓度浓度外,还可采取的措施有______![]() 写出两条
写出两条![]() 。“废渣1”的主要成分是______。
。“废渣1”的主要成分是______。
(2)“酸浸”实验中,钒的浸出率结果如图2所示。由图可知,当钒的浸出率为![]() 时,所采用的实验条件为______。
时,所采用的实验条件为______。
(3)“氧化”中欲使3mol的![]() 变为
变为![]() ,则需要氧化剂
,则需要氧化剂![]() 至少为______mol。
至少为______mol。
(4)“中和”作用之一是使钒以![]() 形式存在于溶液中。“废渣2”中含有______。
形式存在于溶液中。“废渣2”中含有______。
(5)“离子交换”和“洗脱”可简单表示为:![]()
![]()
![]() 为强碱性阴离子交换树脂
为强碱性阴离子交换树脂![]() 。为了提高洗脱效率,淋洗液应该呈______性
。为了提高洗脱效率,淋洗液应该呈______性![]() 填“酸”、“碱”或“中”
填“酸”、“碱”或“中”![]() 。
。
(6)“流出液”中阳离子最多的是______。
(7)“沉钒”得到偏钒酸铵![]() 沉淀,写出“煅烧”中发生反应的化学方程式______。
沉淀,写出“煅烧”中发生反应的化学方程式______。
【题目】下表是甲、乙、丙、丁、戊五种有机物的有关信息:
甲 | ①能使溴的四氯化碳溶液褪色;②比例模型为 |
乙 | ①由C、H两种元素组成;②球棍模型为 |
丙 | ①由C、H、O三种元素组成;②能与Na反应,但不能与 |
丁 | ①相对分子质量比丙少;②能由丙氧化而成 |
戊 | ①由C、H、O三种元素组成;②球棍模型为 |
回答下列问题:
(1)甲与溴的四氯化碳溶液反应所得产物的名称是___________________。
(2)甲与氢气发生加成反应后生成物质己,在己在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式![]() 。当n=___________________时,这类有机物开始出现同分异构体。
。当n=___________________时,这类有机物开始出现同分异构体。
(3)乙具有的性质是___________________(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤与酸性![]() 溶液和溴水反应而使其褪色
溶液和溴水反应而使其褪色
(4)丙与戊反应能生成相对分子质量为100的酯,所发生反应的反应类型为_____________________,对应的化学方程式为_______________________。
(5)写出丙氧化生成丁的化学反应方程式:__________________________________________。