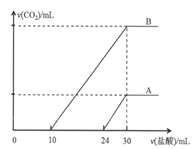
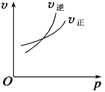
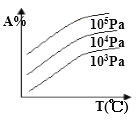
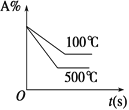
题目内容
【题目】下列化学方程式中,不能正确表达反应颜色变化的是
A. 向CuSO4溶液中加入足量Zn粉,溶液蓝色消失Zn+CuSO4![]() Cu+ZnSO4
Cu+ZnSO4
B. 澄清的石灰水久置后出现白色固体Ca(OH)2+CO2![]() CaCO3↓+H2O
CaCO3↓+H2O
C. Na2O2在空气中放置后由淡黄色变为白色2Na2O2![]() 2Na2O+O2↑
2Na2O+O2↑
D. 向Mg(OH)2悬浊液中滴加足量FeCl3溶液出现红褐色沉淀3Mg(OH)2+2FeCl3![]() 2Fe(OH)3+3MgCl2
2Fe(OH)3+3MgCl2
【答案】C
【解析】
A.金属活动性顺序:Zn>Cu,则向硫酸铜溶液中加入足量锌粉,会发生置换反应,其反应的方程式为:Zn+CuSO4=ZnSO4+Cu,使溶液的蓝色消失,A项正确;
B. 澄清石灰水久置以后会与空气中的二氧化碳反应而生产碳酸钙白色沉淀,其反应的方程式为:CO2+Ca(OH)2=CaCO3↓+H2O,B项正确;
C. 过氧化钠在空气中放置,会与空气中的水蒸气及二氧化碳发生反应,最终生成白色且稳定的碳酸钠,涉及的转化关系有:Na2O2→NaOH→Na2CO3·10H2O→Na2CO3,C项错误;
D.向氢氧化镁悬浊液中滴加足量氯化铁溶液,会发生沉淀的转化,化学方程式为:3Mg(OH)2 + 2FeCl3= 2Fe(OH)3+ 3MgCl2,D项正确;
答案选C。

【题目】现使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL)
Ⅰ.实验步骤
(1)配制100mL待测白醋溶液:用______![]() 填仪器名称
填仪器名称![]() 量取10.00mL市售白醋,在烧杯中用水稀释后转移到______
量取10.00mL市售白醋,在烧杯中用水稀释后转移到______![]() 填仪器容量、名称
填仪器容量、名称![]() 中定容,摇匀即得待测白醋溶液.
中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴_____作指示剂.
(3)读取盛装0.1000mol/LNaOH溶液的碱式滴定管的初始读数:如果液面位置如图所示,则此时的读数为______mL.
![]()
(4)滴定:当________________________________________时,停止滴定,并记录NaOH溶液的终读数,重复滴定3次。
Ⅱ.实验记录
滴定次数实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) |
|
|
|
|
V(NaOH)(消耗) |
|
|
|
|
Ⅲ.数据处理与讨论
(5)甲同学在处理数据时计算得:平均消耗的NaOH溶液的体积:V=![]() =15.24mL指出他的计算的不合理之处:_________________________________________________。
=15.24mL指出他的计算的不合理之处:_________________________________________________。
选取正确数据,可得![]() 市售白醋
市售白醋![]() ____mol/L;市售白醋总酸量
____mol/L;市售白醋总酸量![]() ____g/100mL。
____g/100mL。
(6)乙同学仔细研究了该品牌白醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与苯甲酸钠不会发生离子互换反应,需查找在一定温度下的醋酸与苯甲酸的________(填标号).
A.pHB.电离度C.电离常数D.溶解度
(7)在本实验的滴定过程中,下列操作会使实验结果偏大的是______(填标号).
A.碱式滴定管在用蒸馏水洗净后,未用标准NaOH溶液润洗
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加少量水
D.锥形瓶在滴定时剧烈摇动,有少量液体溅出.
【题目】胆矾![]() 是一种重要的含铜化合物,某课外研究小组用粗铜(含少量
是一种重要的含铜化合物,某课外研究小组用粗铜(含少量![]() )通过不同的化学反应制取胆矾的过程如图:
)通过不同的化学反应制取胆矾的过程如图:

物质 | 完全沉淀时的pH |
Fe(OH)3 | 3.2 |
Fe(OH)2 | 9.6 |
Cu(OH)2 | 6.4 |
当溶液中被沉淀离子的物质的量浓度小于![]() 时,认为该离子沉淀完全。
时,认为该离子沉淀完全。
试回答下列问题:
(1)下列物质中,最适合作为试剂X的是________(填序号)。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(2)由粗铜通过两种途径制取胆矾,与途径Ⅱ相比,途径Ⅰ有明显的两个优点,分别是______________、____________________。
(3)试剂Y可以是______________________(任填一种物质的化学式)。
(4)若溶液C中![]() 、
、![]() 的浓度分别为
的浓度分别为![]() 、
、![]() ,则向溶液C中加入少量试剂Y的过程中应控制溶液C的pH范围约为________。
,则向溶液C中加入少量试剂Y的过程中应控制溶液C的pH范围约为________。
(5)氢化亚铜![]() 是一种红色固体,40~50℃时,滤液E和
是一种红色固体,40~50℃时,滤液E和![]() 溶液混合反应可得氢化亚铜沉淀,同时得到硫酸和磷酸,该反应的离子方程式为___________________________________,该反应每转移1.5
溶液混合反应可得氢化亚铜沉淀,同时得到硫酸和磷酸,该反应的离子方程式为___________________________________,该反应每转移1.5![]() 个电子,生成CuH的物质的量为________mol。
个电子,生成CuH的物质的量为________mol。
(/span>6)纳米氧化亚铜![]() 是一种用途广泛的光电材料,电化学法可用铜棒和石墨作电极,电解滤液E获得纳米氧化亚铜,电解过程中无气体产生,则铜棒作________极,生成
是一种用途广泛的光电材料,电化学法可用铜棒和石墨作电极,电解滤液E获得纳米氧化亚铜,电解过程中无气体产生,则铜棒作________极,生成![]() 的电极反应式为______________________,电解过程中滤液E的浓度____________(填“增大”“不变”或“减小”)。
的电极反应式为______________________,电解过程中滤液E的浓度____________(填“增大”“不变”或“减小”)。
(7)得到![]() 晶体,乙醇代替蒸馏水洗涤晶体的目的是______________。
晶体,乙醇代替蒸馏水洗涤晶体的目的是______________。