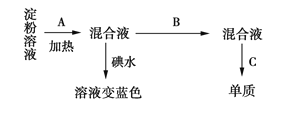
题目内容
【题目】氮元素可以形成多种化合物.请回答以下问题:
⑴基态氮原子的价电子排布式是____________。
⑵肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物.
①请用价电子层对互斥理论推测NH3分子的空间构型是__________________,其中H—N—H的键角为___________________,请根据价层电子对互斥理论解释其键角小于109°28′的原因:_______。
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l) +2N2H4(l)═3N2(g)+4H2O(g) △H=-1038.7kJ·mol﹣1
若该反应中有4mol N—H 键断裂,则形成π 键的数目为__________。
⑶比较氮的简单氢化物与同族第三、四周期元素所形成氢化物的沸点高低并说明理由___________________________________________。
【答案】2s22p3; 三角锥形 107°18′ NH3分子含有1个孤电子对,孤电子对影响键角 3NA NH3>AsH3>PH3,NH3可形成分子间氢键,沸点最高,AsH3相对分子质量比PH3大,分子间作用力大,因而AsH3比PH3沸点高。
【解析】
⑴N基态氮原子电子排布式为1s22s22p3,基态氮原子价电子排布式是2s22p3;故答案为:2s22p3。
⑵①先计算NH3分子中氮原子价层电子对数,根据孤电子对影响键角进行分析;②有4mol N—H键断裂即1mol N2H4反应,生成1.5mol氮气进行分析。
⑶NH3、AsH3、PH3是分子晶体,NH3可形成分子间氢键,AsH3、PH3根据相对分子质量越大,范德华力越大,熔沸点越高进行分析。
⑴N核外有7个电子,其基态氮原子电子排布式为1s22s22p3,基态氮原子价电子排布式是2s22p3;故答案为:2s22p3。
⑵①NH3分子中氮原子价层电子对数为![]() ,推测出NH3分子的空间构型是三角锥形,其中H—N—H的键角为107°18′,请根据价层电子对互斥理论解释其键角小于109°28′的原因是NH3分子含有1个孤电子对,孤电子对影响键角;故答案为:三角锥形;NH3分子含有1个孤电子对,孤电子对影响键角。
,推测出NH3分子的空间构型是三角锥形,其中H—N—H的键角为107°18′,请根据价层电子对互斥理论解释其键角小于109°28′的原因是NH3分子含有1个孤电子对,孤电子对影响键角;故答案为:三角锥形;NH3分子含有1个孤电子对,孤电子对影响键角。
②若该反应中有4mol N—H 键断裂即1mol N2H4反应,生成1.5mol氮气,因此形成π 键的数目为3NA;故答案为:3NA。
⑶比较氮的简单氢化物与同族第三、四周期元素所形成氢化物的沸点高低并说明理由,NH3可形成分子间氢键,沸点最高,AsH3、PH3是分子晶体,根据相对分子质量越大,范德华力越大,熔沸点越高分析得到AsH3相对分子质量比PH3大,分子间作用力大,因而AsH3比PH3沸点高;故答案为:NH3>AsH3>PH3,NH3可形成分子间氢键,沸点最高,AsH3相对分子质量比PH3大,分子间作用力大,因而AsH3比PH3沸点高。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
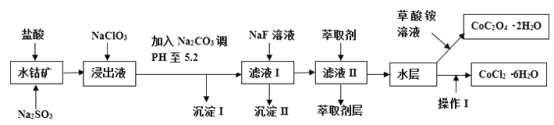
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等;②沉淀I中只含有两种沉淀;③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中Co2O3发生反应的离子反应方程式为_________________。
(2)NaClO3在浸出液中发生的离子反应方程式为______________。
(3)加入Na2CO3调PH至5.2,目的是________;萃取剂层含锰元素,则沉淀II的主要成分为_____。
(4)操作I包括:将水层加入浓盐酸调整PH为2-3,______、_____、过滤、洗涤、减压烘干等过程。
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是_____(回答一条原因即可)。
【题目】三氯胺(NCl3)是一种饮用水二级消毒剂,可由以下反应制备:
Ⅰ.![]()
![]()
回答下列问题:
(1)已知:Ⅱ.![]()
![]()
Ⅲ.![]()
![]()
则![]() =________(用含
=________(用含![]() 和
和![]() 的代数式表示)。
的代数式表示)。
(2)向容积均为2L的甲乙两个恒温密闭容器中分别加入4mol NH3和4mol Cl2,发生反应Ⅰ,测得两容器中n(Cl2)随反应时间的变化情况如下表所示:
时间/min | 0 | 40 | 80 | 120 | 160 |
容器甲(T1) | 4.0 | 3.0 | 2.2 | 1.6 | 1.6 |
容器乙(T2) | 4.0 | 2.9 | 2.0 | 2.0 | 2.0 |
①0~80min内,容器甲中v(NH3)=________________。
②反应Ⅰ的![]() ________0(填“>”或“<”),其原因为________________________。
________0(填“>”或“<”),其原因为________________________。
③关于容器乙,下列说法正确的是________
A.容器内![]() ,说明反应达到平衡状态
,说明反应达到平衡状态
B.反应进行到70min时,v正一定大于v逆
C.容器内气体平均相对分子质量在增大,说明平衡在正向移动
D.达平衡后,加入一定量NCl3(l),平衡逆向移动
E.达平衡后,按原投料比再充入一定量反应物,平衡后NH3的转化率增大
④温度为T1时HCl(g)的平衡体积分数=________,该温度下,若改为初始体积为2L的恒压容器,平衡时容器中n(Cl2)________(填“>”、“=”或“<”)1.6mol。
⑤温度为T2时,该反应的平衡常数K=________。