题目内容
9.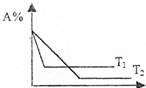 可逆反应A(g)+2B(g)?C(g) 在相同压强时,混和气体中A的百分含量跟反应时间t、温度T的关系如图所示,下列结论正确是( )
可逆反应A(g)+2B(g)?C(g) 在相同压强时,混和气体中A的百分含量跟反应时间t、温度T的关系如图所示,下列结论正确是( )| A. | T1>T2,正反应是放热反应 | B. | T1>T2,正反应是吸热反应 | ||
| C. | T2>T1,正反应是放热反应 | D. | T2>T1,正反应是吸热反应 |
分析 根据图象可知,T1温度下,达到平衡所需的时间短,所以T1>T2,温度高,A%大,因此,升温平衡向逆反应方向移动,逆反应为吸热反应,则正反应为放热反应,据此分析.
解答 解:根据图象可知,T1温度下,达到平衡所需的时间短,所以T1>T2,从T2到T1是升高温度,A%逐渐增大,说明升温平衡向逆反应方向移动,逆反应为吸热反应,则正反应为放热反应;
故选A.
点评 本题考查化学平衡影响影响因素,难度中等,注意根据“先拐先平数值大”判断温度,再根据温度对平衡的影响解答.

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案
相关题目
17.在一定条件下对于100mL 1mol•L-1的Na2CO3溶液,下列说法正确的是( )
| A. | 稀释溶液,c(CO32-)/c(OH-) 增大 | |
| B. | 升高温度,c(CO32-)/c(HCO3-)增大 | |
| C. | 溶液中存在:c(Na+)+c(H+)═c(CO32-)+c(HCO3-)+c(OH-) | |
| D. | 完全吸收0.1molCO2气体后,溶液中存在:c(Na+)═c(CO32-)+c(HCO3-)+c(H2CO3) |
4.20℃,将10ml 0.1mol/L Na2S2O3溶液和10ml 0.1mol/L的H2SO4溶液混合,2分钟后溶液中明显出现浑浊.已知温度每升高10℃,化学反应速率增大到原来的2倍,那么50℃时,要看到明显浑浊,需要的时间是( )
| A. | 20秒 | B. | 15秒 | C. | 40秒 | D. | 48秒 |
18.下列实验与物质微粒大小无直接关系的是( )
| A. |  | B. | 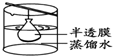 | C. | 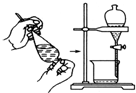 | D. | 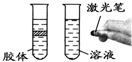 |
 2NH3(g)△H=+92.4kJ•mol﹣1,下列说法正确的是( )
2NH3(g)△H=+92.4kJ•mol﹣1,下列说法正确的是( ) 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标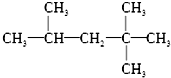 某有机物化合物A的结构简式为:
某有机物化合物A的结构简式为: