题目内容
4.20℃,将10ml 0.1mol/L Na2S2O3溶液和10ml 0.1mol/L的H2SO4溶液混合,2分钟后溶液中明显出现浑浊.已知温度每升高10℃,化学反应速率增大到原来的2倍,那么50℃时,要看到明显浑浊,需要的时间是( )| A. | 20秒 | B. | 15秒 | C. | 40秒 | D. | 48秒 |
分析 已知温度每升高10℃,反应速率增大到原来的2倍,那么在50℃时,温度升高30℃,反应速率应是20℃的23倍=8倍,反应需要时间为原先的$\frac{1}{8}$,以此解答该题.
解答 解:化学反应中,升高温度,反应速率增大,20℃时,将1mL 0.1mo l/L的Na2S2O3溶液和10mL 0.1mol/L的硫酸混合,2分钟后溶液中明显出现浑浊.即120s;已知温度每升高10℃,反应速率增大到原来的2倍,那么在50℃时,温度升高30℃,反应速率应是20℃的23倍=8倍,反应需要时间为原先的$\frac{1}{8}$,则同样的反应出现混浊需要的时间为$\frac{120s}{8}$=15s,
故选B.
点评 本题考查化学反应速率的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握温度升高后速率的变化倍数,为解答该题的关键,难度中等.

练习册系列答案
相关题目
14.异戊二烯与溴水反应的加成产物最多有( )
| A. | 5种 | B. | 2种 | C. | 3种 | D. | 4种 |
将0.1mol•L﹣1的KI溶液和0.05mol•L﹣1 Fe2(SO4)3溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“2Fe3++2I﹣ 2Fe2++I2”的是( )
2Fe2++I2”的是( )
实验编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入AgNO3溶液 | 有黄色沉淀生成 |
③ | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成(用于证明Fe2+存在) |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
A.①和② B.②和④ C.②和③ D.①和③
12.下列说法不正确的是( )
| A. | 需要持续加热才能发生的反应一定是吸热反应 | |
| B. | MnO2能加速H2O2的分解,是因为MnO2可以降低反应所需的活化能 | |
| C. | 分别稀释10mLpH=1的盐酸和醋酸至100mL,后者pH变化大,说明醋酸是弱酸 | |
| D. | 向橙色的K2Cr2O7溶液中滴加NaOH溶液,溶液颜色变黄,说明化学平衡发生了移动 |
19.下列各离子浓度的大小比较,正确的是( )
| A. | 同浓度下列溶液中:①(NH4)2SO4 ②NH4HCO3 ③NH4Cl④NH3•H2O,c(NH4+)由大到小的顺序是:①>③>②>④ | |
| B. | 常温时,将等体积的盐酸和氨水混合后,pH=7,则c (NH4+)>c (Cl-) | |
| C. | 0.2 mol•L-1Na2CO3溶液中:c (OH-)=c (HCO3-)+c (H+)+c (H2CO3) | |
| D. | 0.01 mol•L-1的NH4Cl溶液与0.05mol•L-1的NaOH溶液等体积混合:c (Cl-)>c (NH4+)>c (Na+)>c (OH-)>c (H+) |
9.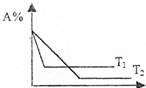 可逆反应A(g)+2B(g)?C(g) 在相同压强时,混和气体中A的百分含量跟反应时间t、温度T的关系如图所示,下列结论正确是( )
可逆反应A(g)+2B(g)?C(g) 在相同压强时,混和气体中A的百分含量跟反应时间t、温度T的关系如图所示,下列结论正确是( )
 可逆反应A(g)+2B(g)?C(g) 在相同压强时,混和气体中A的百分含量跟反应时间t、温度T的关系如图所示,下列结论正确是( )
可逆反应A(g)+2B(g)?C(g) 在相同压强时,混和气体中A的百分含量跟反应时间t、温度T的关系如图所示,下列结论正确是( )| A. | T1>T2,正反应是放热反应 | B. | T1>T2,正反应是吸热反应 | ||
| C. | T2>T1,正反应是放热反应 | D. | T2>T1,正反应是吸热反应 |
 .
.