题目内容
17.在一定条件下对于100mL 1mol•L-1的Na2CO3溶液,下列说法正确的是( )| A. | 稀释溶液,c(CO32-)/c(OH-) 增大 | |
| B. | 升高温度,c(CO32-)/c(HCO3-)增大 | |
| C. | 溶液中存在:c(Na+)+c(H+)═c(CO32-)+c(HCO3-)+c(OH-) | |
| D. | 完全吸收0.1molCO2气体后,溶液中存在:c(Na+)═c(CO32-)+c(HCO3-)+c(H2CO3) |
分析 Na2CO3溶液中存在水解平衡:CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-.
A、稀释溶液,Na2CO3的水解平衡右移,CO32-的物质的量减少,水解出的OH-的物质的量增多,据此分析;
B、盐类水解吸热,升温会导致水解平衡右移,c(CO32-)减少,水解出的c(HCO3-)增多;
C、根据溶液的电荷守恒来分析;
D、溶液中Na2CO3的物质的量为0.1mol,完全吸收0.1molCO2气体后恰好完全反应生成0.1molNaHCO3,根据物料守恒来分析.
解答 解:Na2CO3溶液中存在水解平衡:CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-.
A、稀释溶液,Na2CO3的水解平衡右移,n(CO32-)减少,水解出的n(OH-)增多,$\frac{n(C{{O}_{3}}^{2-})}{n(O{H}^{-})}$减小,故$\frac{\frac{n(C{{O}_{3}}^{2-})}{V}}{\frac{n(O{H}^{-})}{V}}$=$\frac{c(C{{O}_{3}}^{2-})}{c(O{H}^{-})}$减小,故A错误;
B、盐类水解吸热,升温会导致水解平衡右移,c(CO32-)减少,水解出的c(HCO3-)增多,故c(CO32-)/c(HCO3-)减小,故B错误;
C、溶液中Na2CO3的物质的量为0.1mol,完全吸收0.1molCO2气体后恰好完全反应生成0.1molNaHCO3,HCO3-既能水解为H2CO3又能电离为CO32-,根据物料守恒可有:c(Na+)═c(CO32-)+c(HCO3-)+c(H2CO3),故D正确.
故选D.
点评 本题考查了影响盐溶液水解平衡的因素和平衡移动后溶液中离子浓度的变化,难度不大,注意掌握盐溶液中的三个守恒.

| A. | 需要持续加热才能发生的反应一定是吸热反应 | |
| B. | MnO2能加速H2O2的分解,是因为MnO2可以降低反应所需的活化能 | |
| C. | 分别稀释10mLpH=1的盐酸和醋酸至100mL,后者pH变化大,说明醋酸是弱酸 | |
| D. | 向橙色的K2Cr2O7溶液中滴加NaOH溶液,溶液颜色变黄,说明化学平衡发生了移动 |
| A. | 在pH=0的溶液中:Na+、K+、MnO4-、Cl- | |
| B. | 和Al反应能产生氢气的溶液:K+、NH4+、Cl-、CO32- | |
| C. | 中性溶液:Al3+、K+、SO42-、Cl- | |
| D. | c(H+)<c(OH-)的溶液:Na+、K+、SO32-、S2- |
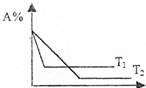 可逆反应A(g)+2B(g)?C(g) 在相同压强时,混和气体中A的百分含量跟反应时间t、温度T的关系如图所示,下列结论正确是( )
可逆反应A(g)+2B(g)?C(g) 在相同压强时,混和气体中A的百分含量跟反应时间t、温度T的关系如图所示,下列结论正确是( )| A. | T1>T2,正反应是放热反应 | B. | T1>T2,正反应是吸热反应 | ||
| C. | T2>T1,正反应是放热反应 | D. | T2>T1,正反应是吸热反应 |
| A. | CO32-Cl- Na+ H+ | B. | K+ Na+ SO42- Ba2+ | ||
| C. | Cl- Na+ Ag+ NO3- | D. | CO32- SO42- Cl- OH- |
 CH3CH2OH(g)+3H2O(g)需在300℃进行可推测该反应是吸热反应
CH3CH2OH(g)+3H2O(g)需在300℃进行可推测该反应是吸热反应