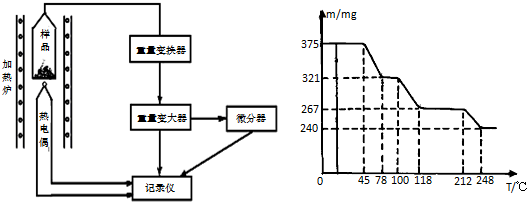
题目内容
14. 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制100mL 1mol•L-1的稀硫酸.
可供选用的仪器有:
①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平.
请回答下列问题:
(1)配制稀硫酸时,还缺少的仪器有100mL容量瓶、玻璃棒(写仪器名称);
(2)经计算,配制100mL1mol•L-1的稀硫酸需要用量筒量取上述浓硫酸的体积
为5.4mL,量取硫酸时应选用AmL规格的量筒;(填正确的字母选项)
A.10mL B.50mL C.100mL D.200mL
(3)对所配制的稀硫酸进行测定,发现其浓度大于1mol•L-1,配制过程中下列各项操作可能引起该误差的原因ACE.
A.用量筒量取浓硫酸时,仰视刻度线取浓硫酸
B.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
C.将稀释后的稀硫酸立即转入容量瓶后,紧接着就进行以后的实验操作
D.转移溶液时,不慎有少量溶液洒到容量瓶外面
E.定容时,俯视容量瓶刻度线进行定容
F.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处.
分析 (1)根据配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(2)先计算出浓硫酸的物质的量浓度为c=$\frac{1000ρω}{M}$,然后根据溶液稀释定律C浓V浓=C稀V稀来计算;根据“大而近”的原则,根据需要量取的浓硫酸的体积来选择合适的量筒;
(3)根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析.
解答 解:(1)根据配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶可知所需的仪器有:量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管,故还缺少的仪器有100mL容量瓶、玻璃棒,故答案为:100mL容量瓶、玻璃棒;
(2)浓硫酸的物质的量浓度为c=$\frac{1000ρω}{M}$=$\frac{1000×1.84×98%}{98}$=18.4mol/L,设需要浓硫酸的体积为VmL,根据溶液稀释定律C浓V浓=C稀V稀可知:
18.4mol/L×VmL=1mol/L×100mL
解得:V=5.4mL;
根据“大而近”的原则,故应选用10mL的量筒,故答案为:5.4;A;
(3)A.用量筒量取浓硫酸时,仰视刻度线取浓硫酸,则所量取的浓硫酸的体积偏大,故配制的出的溶液的浓度偏高,故A正确;
B.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水,对所配溶液的浓度无影响,故B错误;
C.将稀释后的稀硫酸未冷却立即转入容量瓶后,紧接着就进行以后的实验操作,则配制好的溶液冷却后体积偏小,浓度偏高,故C正确;
D.转移溶液时,不慎有少量溶液洒到容量瓶外面,会导致溶质的损失,则浓度偏小,故D错误;
E.定容时,俯视容量瓶刻度线进行定容,则溶液体积偏小,浓度偏高,故E正确;
F.定容后,把容量瓶倒置摇匀后发现液面低于刻度线是正常的,补充几滴水至刻度处会导致浓度偏低,故F错误.
故选ACE.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案| A. | 在pH=0的溶液中:Na+、K+、MnO4-、Cl- | |
| B. | 和Al反应能产生氢气的溶液:K+、NH4+、Cl-、CO32- | |
| C. | 中性溶液:Al3+、K+、SO42-、Cl- | |
| D. | c(H+)<c(OH-)的溶液:Na+、K+、SO32-、S2- |
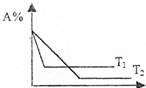 可逆反应A(g)+2B(g)?C(g) 在相同压强时,混和气体中A的百分含量跟反应时间t、温度T的关系如图所示,下列结论正确是( )
可逆反应A(g)+2B(g)?C(g) 在相同压强时,混和气体中A的百分含量跟反应时间t、温度T的关系如图所示,下列结论正确是( )| A. | T1>T2,正反应是放热反应 | B. | T1>T2,正反应是吸热反应 | ||
| C. | T2>T1,正反应是放热反应 | D. | T2>T1,正反应是吸热反应 |
| A. | H2SO4=2H++SO42- | B. | Ba(OH)2=Ba2++2OH- | ||
| C. | Na2CO3=2Na+1+CO3-2 | D. | NaHCO3=Na++HCO3- |
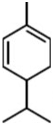 α-非兰烃是从薄荷油中得到的一种烃,其结构简式如图,α-非兰烃的分子式为C10H16,它与等物质的量的Br2进行加成反应的产物共有3种(不考虑立体异构.)
α-非兰烃是从薄荷油中得到的一种烃,其结构简式如图,α-非兰烃的分子式为C10H16,它与等物质的量的Br2进行加成反应的产物共有3种(不考虑立体异构.)