题目内容
17.(1)将等物质的量的Na2O和Na2O2样品分别放入等量的水中,所得溶液的质量分数分别为a%和b%,则a,b的关系是a=b(填“<”“>”“=”);(2)将等质量的Na2O和Na2O2样品分别放入等量的水中,所得溶液的质量分数分别为a%和b%,则a,b的关系是a>b(填“<”“>”“=”).
分析 根据方程式:Na2O+H2O=2NaOH、2Na2O2+2H2O=4NaOH+O2↑利用差量法来解答;
解答 解:(1)设物质的量都为1mol,则
Na2O+H2O=2NaOH△m
1mol 2mol 62g
2Na2O2+2H2O=4NaOH+O2↑△m
1mol 2mol 62g
由方程式可知,生成溶质的物质的量相等,则溶质的质量相等,反应后两溶液的质量相等,则两溶液溶质质量分数相等,即a=b;
故答案为:=;
(2)设质量都为1g,水的质量分别为mg,则
Na2O+H2O=2NaOH△m
1mol 2mol 62g
$\frac{1}{62}$mol $\frac{1}{31}$mol 1g
溶质的质量为$\frac{40}{31}$g,溶液的质量分数分别为$\frac{\frac{40}{31}}{m+1}$×100%=$\frac{40}{31m+31}$×100=a%
2Na2O2+2H2O=4NaOH+O2↑△m
2mol 4mol 124
$\frac{1}{78}$mol $\frac{1}{39}$mol $\frac{64}{78}$g
溶质的质量为$\frac{40}{39}$g,溶液的质量分数分别为$\frac{\frac{40}{39}}{m+\frac{64}{78}}$×100%=$\frac{40}{39m+32}$×100%=b%
由于31m+31<39m+32,所以a%>b%,即a>b;
故答案为:>.
点评 本题考查溶液质量分数的计算,题目难度中等,注意本题根据反应的化学方程式进行定量计算.

 阅读快车系列答案
阅读快车系列答案| A. | 水能微弱的电离,是电解质 | B. | 单质铜能导电,但不是电解质 | ||
| C. | 硫酸钡难溶于水,但是电解质 | D. | 氯化氢是气体,所以不是电解质 |
| A. | 5种 | B. | 2种 | C. | 3种 | D. | 4种 |
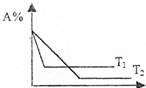 可逆反应A(g)+2B(g)?C(g) 在相同压强时,混和气体中A的百分含量跟反应时间t、温度T的关系如图所示,下列结论正确是( )
可逆反应A(g)+2B(g)?C(g) 在相同压强时,混和气体中A的百分含量跟反应时间t、温度T的关系如图所示,下列结论正确是( )| A. | T1>T2,正反应是放热反应 | B. | T1>T2,正反应是吸热反应 | ||
| C. | T2>T1,正反应是放热反应 | D. | T2>T1,正反应是吸热反应 |
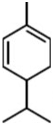 α-非兰烃是从薄荷油中得到的一种烃,其结构简式如图,α-非兰烃的分子式为C10H16,它与等物质的量的Br2进行加成反应的产物共有3种(不考虑立体异构.)
α-非兰烃是从薄荷油中得到的一种烃,其结构简式如图,α-非兰烃的分子式为C10H16,它与等物质的量的Br2进行加成反应的产物共有3种(不考虑立体异构.) CH3CH2OH(g)+3H2O(g)需在300℃进行可推测该反应是吸热反应
CH3CH2OH(g)+3H2O(g)需在300℃进行可推测该反应是吸热反应