题目内容
17.下列粒子属等电子体的是( )| A. | SO2和O3 | B. | CH4和NH4+ | C. | NH2-和H2O2 | D. | HCl和H2O |
分析 等电子体指两个或两个以上的分子或离子,它们的原子数目相同,价电子数目也相同,常具有相似的电子结构,相似的几何构型,而且有时在性质上也有许多相似之处,据此解答即可.
解答 解:A.SO2和O3中含有3个原子,SO2的价电子数是6+6×2=18,O3的价电子数是6×3=18,所以是等电子体,故A选;
B.CH4和NH4+中含有5个原子,甲烷的价电子数是4+4=8,铵根的价电子数是5+4-1=8,所以是等电子体,故B选;
C.NH2-和H2O2,原子个数不相同,所以不是等电子体,故C不选;
D.HCl和H2O,原子个数不相同,所以不是等电子体,故D不选;
故选AB.
点评 本题考查了等电子体的判断,根据等电子体的概念来分析解答即可,题目难度不大.

练习册系列答案
相关题目
6.铜锌原电池(如图)工作时,下列叙述正确的是( )
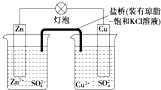

| A. | 正极反应为:Zn-2e-═Zn2+ | B. | 盐桥中的K+移向ZnSO4溶液 | ||
| C. | 在外电路中,电流从负极流向正极 | D. | 电池反应为:Zn+Cu2+═Zn2++Cu |
5.下列有机物的转化中没有进行的反应类型是( )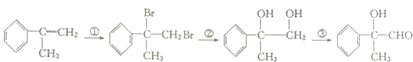

| A. | 加成反应 | B. | 消去反应 | C. | 取代反应 | D. | 氧化反应 |
2.下列说法正确的是( )
| A. | 室温下,在水中的溶解度:丙三醇>苯酚>1-氯丁烷 | |
| B. | 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 | |
| C. | 用Na2CO3溶液不能区分CH3COOH和CH3COOCH2CH3 | |
| D. | 油脂在酸性或碱性条件下均能发生水解反应,且产物相同 |
9.取x g铜和镁的合金完全溶于浓硝酸,若反应中硝酸被还原只产生8960mL NO2气体和672mL N2O4气体(都已折算成标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为17.02g,则x等于( )
| A. | 8.64 g | B. | 9.00 g | C. | 9.20 g | D. | 9.44 g |
6.下列关于离子化合物和共价化合物的叙述中正确的是( )
| A. | 离子化合物一定只含离子键 | |
| B. | 共价化合物可能含有离子键 | |
| C. | 只含离子键的纯净物一定是离子化合物 | |
| D. | 只含共价键的纯净物一定是共价化合物 |
7.短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第VA族,甲和丙同主族,丁原子最外层电子数与电子层数相等,则下列说法正确的是( )
| A. | 原子半径:丁>丙>乙>甲 | |
| B. | 单质的还原性:丁>丙>甲 | |
| C. | 甲、乙、丙的氧化物均为共价化合物 | |
| D. | 乙、丙、丁的最高价氧化物对应的水化物能相互反应 |
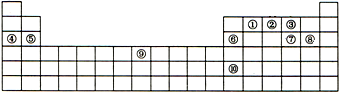 下表是元素周期表的一部分,表中每一序号分别代表一种元素.
下表是元素周期表的一部分,表中每一序号分别代表一种元素. 四川多产五倍子,以五倍子为原料可制得化合物A,A的结构简式如图所示:
四川多产五倍子,以五倍子为原料可制得化合物A,A的结构简式如图所示: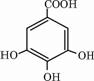 .
.