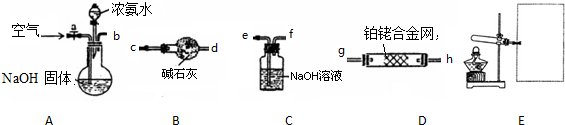题目内容
11.氕化锂、氘化锂、氚化锂可能作为火箭优良燃料,下列说法正确的是( )| A. | LiH、LiD、LiT的摩尔质量之比为1:2:3 | |
| B. | 一个T原子的质量约为$\frac{2}{6.02}$×1023g | |
| C. | H、D、T的中子数之比为1:2:3 | |
| D. | 氕化锂、氘化锂、氚化锂都是强还原剂 |
分析 A.摩尔质量以g/mol为单位,在数值等于物质的相对分子质量;
B.T原子质量数为3,摩尔质量约是3g/mol;
C.H原子中只含有质子,没有中子;
D.LiH、LiD、LiT中氢元素为-1价,都具有较强的还原性.
解答 解:A.摩尔质量以g/mol为单位,在数值等于物质的相对分子质量,LiH、LiD、LiT的摩尔质量之比应为8:9:10,故A错误;
B.T原子质量数为3,摩尔质量约是3g/mol,即一个T原子的质量约是$\frac{3}{6.02}$×10-23g,故B错误;
C.H、D、T的中子数分别为0、1、2,H、D、T的质量数之比为1:2:3,故C错误;
D.LiH、LiD、LiT中氢元素为-1价,都是强还原剂,故D正确,
故选D.
点评 本题考查摩尔质量、原子构成、氧化还原反应等,侧重对基础知识的巩固,注意氕原子中不含中子,为易错点.

练习册系列答案
相关题目
4.下列反应中生成物总能量高于反应物总能量的是( )
| A. | 氢氧化钠溶液与稀盐酸混合 | |
| B. | 氢氧化钡晶体与氯化铵晶体混合搅拌 | |
| C. | 乙醇燃烧 | |
| D. | 铝热反应 |
5.下列属于复分解反应的是( )
| A. | NH4HCO3 $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑ | |
| B. | C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O | |
| C. | 3Cl2+6NaOH═5NaCl+NaClO3+3H2O | |
| D. | 2HCl+CaCO3═CaCl2+CO2↑+H2O |
2.根据如图海水综合利用的工业流程图,判断下列说法正确的是( )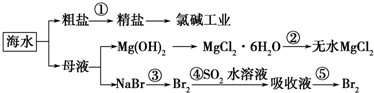

| A. | 除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 在过程②中将MgCl2•6H2O灼烧即可制得无水MgCl2 | |
| C. | 从能量转换角度来看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程 | |
| D. | 从第③步到第⑤步的目的是为了浓缩 |
6.在下列各溶液中,离子一定能大量共存的是( )
| A. | 碱性溶液中:K+、Mg2+、S2-、ClO- | |
| B. | 室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42- | |
| C. | 加入铝粉有气泡产生的溶液中:Na+、NH4+、Fe2+、NO3- | |
| D. | 在AlCl3溶液中:K+、Na+、HCO3-、SO42- |
16.一定能在下列溶液中大量共存的离子组是( )
| A. | AlCl3溶液:Na+、K+、SO42-、AlO2- | |
| B. | KW/c(OH-)=0.1mol/L的溶液:Na+、Mg2+、NO3-、S2- | |
| C. | 无色溶液:Na+、Ca2+、I-、NO3- | |
| D. | 能使甲基橙呈黄色的溶液:H+、ClO-、Fe2+、Ag+ |