题目内容
3.如图所示为制取干燥的氨气,并验证氨的某些性质,请根据要求回答下列问题
(1)C装置用于上述实验的尾气处理,其中发生的反应如下,请配平该反应:
1NO+1NO2+2NaOH=2NaNO2+1H2O
用该原理处理为气的不足之处是容易发生倒吸;
(2)上述装置接口的连接顺序为bcdgghef(填小写字母).
(3)如何检验装置A的气密性:关闭活塞a,关闭活塞b,将导气管深入水槽中,微热圆底烧瓶,水槽中的导气管口有气泡逸出,停止加热,水槽中的导气管内形成一段水柱,长时间不回落,则装置A的气密性良好.实验中观察到D内有红棕色气体出现,证明氨气具有还原性.
(4)图E为实验室制取氨气的发生装置,请在虚线框内画出收集氨气的装置图.
分析 (1)依据方程式判断反应物生成物中元素化合价变化,结合氧化还原反应得失电子守恒规律、原子个数守恒规律配平方程式;二氧化氮、一氧化氮与氢氧化钠反应被吸收,压强迅速减小,容易发生倒吸;
(2)依据氨气的发生装置,干燥装置,性质检验装置,尾气处理装置排序解答;
(3)根据检查装置气密性的方法进行分析;红棕色气体为二氧化氮,氨气中的氮元素化合价升高,说明被氧化发生氧化反应;
(4)氨气密度小于空气密度,应选择向下排气法收集.
解答 解:(1)从方程式可知:反应中NO中的N由+2价升高到+3价,NO2中的N由+4价降为+3价,依据得失电子守恒,NO系数为1,NO2系数为1,结合原子个数守恒可知该反应方程式为:NO+NO2+2NaOH=2NaNO2 +H2O;二氧化氮、一氧化氮与氢氧化钠反应被吸收,压强迅速减小,容易发生倒吸;
故答案为:1,1,2,2,1;容易发生倒吸;
(2)为制取干燥的氨气,并验证氨的某些性质,应该按照氨气的发生装置,干燥装置,性质检验装置连接,所以正确的顺序为:bcdgghef;
故答案为:bcdgghef;
(3)检验装置A的气密性方法是:关闭活塞a,关闭活塞b,将导气管深入水槽中,微热圆底烧瓶,水槽中的导气管口有气泡逸出,停止加热,水槽中的导气管内形成一段水柱,长时间不回落,则装置A的气密性良好;氨气反应生成红棕色气体二氧化氮,说明被氧气,具有还原性;
故答案为:关闭活塞a,关闭活塞b,将导气管深入水槽中,微热圆底烧瓶,水槽中的导气管口有气泡逸出,停止加热,水槽中的导气管内形成一段水柱,长时间不回落,则装置A的气密性良好;还原;
(4)氨气密度小于空气密度,应选择向下排气法收集,收集装置图为: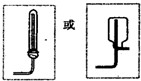 ;
;
故答案为: .
.
点评 本题考查了氨气的制备和性质的检验,熟悉反应原理及氨气的性质是解题关键,题目难度不大.

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案| A. | 光导纤维 | B. | 金属陶瓷 | C. | 聚苯乙烯 | D. | 形状记忆合金 |
| A. | 除去FeSO4溶液中的CuSO4可加入适量铁粉,再过滤 | |
| B. | 通过灼热的CuO除去H2中的CO | |
| C. | 除去NaCl中少量的Na2SO4可依次加入BaCl2、Na2CO3、HCl溶液 | |
| D. | 除去溴苯中的溴,可用NaOH溶液洗涤,再分液 |
| A. | LiH、LiD、LiT的摩尔质量之比为1:2:3 | |
| B. | 一个T原子的质量约为$\frac{2}{6.02}$×1023g | |
| C. | H、D、T的中子数之比为1:2:3 | |
| D. | 氕化锂、氘化锂、氚化锂都是强还原剂 |
| A. | 电池放电时,溶液中的阳离子移向正极 | |
| B. | 电池放电时,H2是正极 | |
| C. | 电池充电时,氢元素被氧化 | |
| D. | 电池放电时,电池负极周围溶液的pH不断增大 |
| A. | 1H218O与D216O的相对分子质量相同 | |
| B. | H2O与D2O互称同素异形体 | |
| C. | 氘(D)原子核外有1个电子 | |
| D. | 1H与D互为同位素 |
 如图A是实验室制取某些气体的装置.
如图A是实验室制取某些气体的装置.