题目内容
16.一定能在下列溶液中大量共存的离子组是( )| A. | AlCl3溶液:Na+、K+、SO42-、AlO2- | |
| B. | KW/c(OH-)=0.1mol/L的溶液:Na+、Mg2+、NO3-、S2- | |
| C. | 无色溶液:Na+、Ca2+、I-、NO3- | |
| D. | 能使甲基橙呈黄色的溶液:H+、ClO-、Fe2+、Ag+ |
分析 A.氯化铝电离出的铝离子与偏铝酸根离子发生双水解反应生成氢氧化铝沉淀;
B.该溶液中存在大量氢离子,硝酸根离子在酸性条件下能够氧化硫离子,硫离子与镁离子直接发生双水解反应;
C.四种离子之间不反应,都是无色离子;
D.使甲基橙变黄的溶液为酸性或碱性溶液,次氯酸根离子与氢离子结合生成次氯酸,次氯酸根离子能够氧化亚铁离子,次氯酸根离子、氢氧根离子与银离子反应.
解答 解:A.AlCl3与溶液中AlO2-发生双水解反应生成氢氧化铝,在溶液中不能大量共存,故A错误;
B.KW/c(OH-)=0.1mol/L的溶液中存在大量氢离子,NO3-、S2-在酸性溶液中发生氧化还原反应,Mg2+、S2-之间发生双水解反应,在溶液中不能大量共存,故B错误;
C.Na+、Ca2+、I-、NO3-之间不发生反应,都是无色离子,在溶液中能够大量共存,故C正确;
D.使甲基橙呈黄色的溶液大于4.4,可能为酸性或碱性溶液,H+、Fe2+、Ag+与碱性溶液中的氢氧根离子反应,ClO-、Fe2+之间发生氧化还原反应,H+、ClO-之间结合生成次氯酸,ClO-、Ag+之间发生双水解反应,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
相关题目
9.糖类、油脂和蛋白质是生命活动所必需的营养物质.下列叙述正确的是( )
| A. | 蛋白质遇浓硫酸变为黄色 | B. | 蔗糖水解产物仅有葡萄糖 | ||
| C. | 纤维素不能水解成葡萄糖 | D. | 油脂水解产物之一是甘油 |
10.A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍.B在D中充分燃烧能生成其最高价化合物BD2.E+与D2-具有相同的电子数.A在F中燃烧,产物溶于水得到一种强酸.
回答下列问题:
(1)A在周期表中的位置是第一周期IA族,写出实验室制备单质F的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为纯碱.
(3)由这些元素组成的物质,其组成和结构信息如下表:
a的化学式为NaH;b的化学式为Na2O2和Na2C2;c的电子式为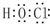 .
.
回答下列问题:
(1)A在周期表中的位置是第一周期IA族,写出实验室制备单质F的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为纯碱.
(3)由这些元素组成的物质,其组成和结构信息如下表:
| 物质 | 组成和结构信息 |
| a | 含有A的二元离子化合物 |
| b | 含有共价键的二元离子化合物,且原子数之比为1:1 |
| c | 化学组成为ADF |
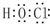 .
.
4.食品安全、资源充分利用、保护环境备受关注,下列做法与此理念相违背的是( )
| A. | 食品中大量添加苯甲酸钠等防腐剂,可有效延长其保质期 | |
| B. | “地沟油”可以制成生物柴油,提高资源的利用率 | |
| C. | 发展光伏发电等高效清洁能源,缓解能源危机 | |
| D. | 大力发展公共交通,提高汽油的质量,对减轻雾霾很有必要 |
11.氕化锂、氘化锂、氚化锂可能作为火箭优良燃料,下列说法正确的是( )
| A. | LiH、LiD、LiT的摩尔质量之比为1:2:3 | |
| B. | 一个T原子的质量约为$\frac{2}{6.02}$×1023g | |
| C. | H、D、T的中子数之比为1:2:3 | |
| D. | 氕化锂、氘化锂、氚化锂都是强还原剂 |
1.下述实验不能达到预期目的是( )
| 编号 | 实验内容 | 实验目的 |
| A | 向盛有10滴0.1 mol/LAgNO3溶液的试管中滴加0.1 mol/NaCl容液,至不再有沉淀生成,再向其中滴加0.lmol/LNa2S 溶液 | 证明在相同温度下,溶解度:AgCl>Ag2S |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明Na2CO2溶液中存在水解平衡 |
| C | 分别向2mL甲苯、2mL苯、2niL正己烷中加入 3滴酸性高锰酸钾溶液,振荡,甲苯中酸性高锰酸钾溶液褪色,而苯、正己烷中酸性高锰酸钾溶液不褪色 | 证明与苯环相连的甲基易被氧化 |
| D | 取两只试管,分别加入4mL0.01mol/L KMn04酸性溶液,然后向一只试管中加入0.1mol/LH2C2O4溶液2mL,向另一只试管中加入0.1mol/LH2C2O4液4mL记录褪色时间 | 证明草酸浓度越大反应速率越快 |
| A. | A | B. | B | C. | C | D. | D |
8.氢镍电池是一种应用广泛的可充电电池,它可以取代会产生镉污染的镉镍电池.氢镍电池的总反应为$\frac{1}{2}$H2+NiO(OH)$?_{充电}^{放电}$Ni(OH)2.据此判断,下列叙述中正确的是( )
| A. | 电池放电时,溶液中的阳离子移向正极 | |
| B. | 电池放电时,H2是正极 | |
| C. | 电池充电时,氢元素被氧化 | |
| D. | 电池放电时,电池负极周围溶液的pH不断增大 |
5.在研究物质变化时,不但要着眼于物质种类的变化,也要关注物质状态的变化.
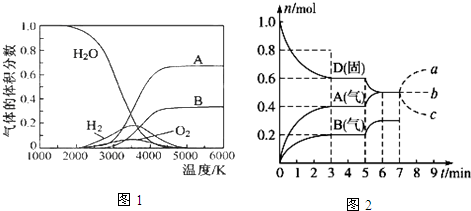
(1)高温下水分解体系中主要物质的体积分数与温度的关系如图1所示.下列说法正确的是C
A.图中A、B表示的粒子依次是O和H
B.图中A、B表示的粒子依次是H+和O2-
C.图中A、B重新生成水时的活化能等于0
D.图中A、B重新生成水时的活化能大于0
(2)已知H2的燃烧热△H=-285.8kJ/mol,且H2O的汽化热为44.0kJ/mol.试写出H2燃烧生成水蒸气的热化学方程式H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol.
(3)在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图2,据图回答下列问题:
①从反应开始到第一次达到平衡时,用A物质表示的平均反应速率为0.067 mol/(L•min)(保留2位有效数字)
②第5min时,升高温度,A、B、D的物质的量变化如图,则该反应为吸热(填“吸热”或“放热”)反应.
③若在第7min时增加D的物质的量,其他条件不变,则A的物质的量图象变化正确的是b(用图中a、b、c的编号回答)
(4)在100℃、200KPa的条件下,反应aA(g)?bB(g)+cC(g)建立平衡后,在不加入任何物质的条件下,逐步增大体系的压强(维持温度不变),如表列出的是不同压强下反应建立平衡时物质B的浓度.根据表中的数据,回答下列问题:
①比较大小:a= b+c(填“>”、“<”或“=”)
②压强从500KPa增加到1000KPa时,平衡正向移动(填“正向”、“逆向”或“不移动”),其原因可能为压强增大为原来的两倍,B浓度的变化大于两倍,说明C在增大压强时变为非气体,平衡正向移动.

(1)高温下水分解体系中主要物质的体积分数与温度的关系如图1所示.下列说法正确的是C
A.图中A、B表示的粒子依次是O和H
B.图中A、B表示的粒子依次是H+和O2-
C.图中A、B重新生成水时的活化能等于0
D.图中A、B重新生成水时的活化能大于0
(2)已知H2的燃烧热△H=-285.8kJ/mol,且H2O的汽化热为44.0kJ/mol.试写出H2燃烧生成水蒸气的热化学方程式H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol.
(3)在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图2,据图回答下列问题:
①从反应开始到第一次达到平衡时,用A物质表示的平均反应速率为0.067 mol/(L•min)(保留2位有效数字)
②第5min时,升高温度,A、B、D的物质的量变化如图,则该反应为吸热(填“吸热”或“放热”)反应.
③若在第7min时增加D的物质的量,其他条件不变,则A的物质的量图象变化正确的是b(用图中a、b、c的编号回答)
(4)在100℃、200KPa的条件下,反应aA(g)?bB(g)+cC(g)建立平衡后,在不加入任何物质的条件下,逐步增大体系的压强(维持温度不变),如表列出的是不同压强下反应建立平衡时物质B的浓度.根据表中的数据,回答下列问题:
| 压强(KPa) | 200 | 500 | 1000 |
| B的浓度(mol/L) | 0.04 | 0.1 | 0.27 |
②压强从500KPa增加到1000KPa时,平衡正向移动(填“正向”、“逆向”或“不移动”),其原因可能为压强增大为原来的两倍,B浓度的变化大于两倍,说明C在增大压强时变为非气体,平衡正向移动.
6.下列离子方程式书写正确的是( )
| A. | 铁和盐酸:Fe+2H+═Fe3++H2↑ | |
| B. | 石灰石和硝酸:CO32-+2H+═H2O+CO2↑ | |
| C. | 铜和硝酸银溶液:Cu+Ag+═Cu2++Ag | |
| D. | 氢氧化钡溶液和硫酸:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |