题目内容
5.下列属于复分解反应的是( )| A. | NH4HCO3 $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑ | |
| B. | C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O | |
| C. | 3Cl2+6NaOH═5NaCl+NaClO3+3H2O | |
| D. | 2HCl+CaCO3═CaCl2+CO2↑+H2O |
分析 复分解反应:由两种化合物相互交换成份生成另外两种化合物的反应.
特点:双交换,价(化合价)不变,公式:AB+CD→AD+CB.据此判断即可.
解答 解:A、一种物质分解生成三种物质,属于分解反应,故A错误;
B、一种单质与化合物反应生成三种化合物,不属于四大基本反应类型,故B错误;
C、一种单质与化合物反应生成三种化合物,不属于四大基本反应类型,故C错误;
D、碳酸常温分解产生二氧化碳和水,故此反应是由两种化合物相互交换成份生成另外两种化合物的反应,属于复分解反应,故D正确,
故选D.
点评 本题主要考查的是复分解反应的判断,掌握四大基本反应类型各自的特点是解决本题的关键,四大反应为:化合反应、分解反应、置换反应、复分解反应.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.磷酸铁锂电池应用广泛.该锂电池将锂嵌入碳材料,含Li+导电固体为电解质;电解质中迁移介质是一种有机聚合物,其单体之一M结构简式如图:电池反应为:LiC6+FePO4$?_{充电}^{放电}$LiFePO4+6C,下列说法正确的是( )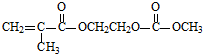
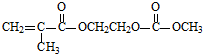
| A. | 放电时,体系中的Li+向负极移动 | |
| B. | 放电时,FePO4作正极发生氧化反应 | |
| C. | 充电时,与电源正极相连的电极反应为:LiFePO4-e-═Li++FePO4 | |
| D. | 1 mol有机物M与足量NaOH溶液反应,消耗2 mol NaOH |
16.化学帮助人类从直接利用天然材料迈向创造和合成有特定性能的材料.下列材料中,属于有机高分子材料的是( )
| A. | 光导纤维 | B. | 金属陶瓷 | C. | 聚苯乙烯 | D. | 形状记忆合金 |
20.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 常温下,1mol Fe与足量稀HNO3反应,转移电子的数目为2NA | |
| B. | 18gD2O中含有的质子数目为10NA | |
| C. | 标准状况下,22.4L二氯甲烷的分子数约为NA | |
| D. | 28g由C2H4和C3H6组成的混合物中含有氢原子的数目为4NA |
10.A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍.B在D中充分燃烧能生成其最高价化合物BD2.E+与D2-具有相同的电子数.A在F中燃烧,产物溶于水得到一种强酸.
回答下列问题:
(1)A在周期表中的位置是第一周期IA族,写出实验室制备单质F的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为纯碱.
(3)由这些元素组成的物质,其组成和结构信息如下表:
a的化学式为NaH;b的化学式为Na2O2和Na2C2;c的电子式为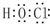 .
.
回答下列问题:
(1)A在周期表中的位置是第一周期IA族,写出实验室制备单质F的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为纯碱.
(3)由这些元素组成的物质,其组成和结构信息如下表:
| 物质 | 组成和结构信息 |
| a | 含有A的二元离子化合物 |
| b | 含有共价键的二元离子化合物,且原子数之比为1:1 |
| c | 化学组成为ADF |
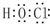 .
.
17.下列说法错误的是( )
| A. | 除去FeSO4溶液中的CuSO4可加入适量铁粉,再过滤 | |
| B. | 通过灼热的CuO除去H2中的CO | |
| C. | 除去NaCl中少量的Na2SO4可依次加入BaCl2、Na2CO3、HCl溶液 | |
| D. | 除去溴苯中的溴,可用NaOH溶液洗涤,再分液 |
11.氕化锂、氘化锂、氚化锂可能作为火箭优良燃料,下列说法正确的是( )
| A. | LiH、LiD、LiT的摩尔质量之比为1:2:3 | |
| B. | 一个T原子的质量约为$\frac{2}{6.02}$×1023g | |
| C. | H、D、T的中子数之比为1:2:3 | |
| D. | 氕化锂、氘化锂、氚化锂都是强还原剂 |
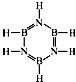 已知化合物B3N3H6(硼氮苯)与C6H6(苯)为等电子体,分子结构如图.则硼氮苯的四氯取代物B3N3H2Cl4的同分异构体的数目为( )
已知化合物B3N3H6(硼氮苯)与C6H6(苯)为等电子体,分子结构如图.则硼氮苯的四氯取代物B3N3H2Cl4的同分异构体的数目为( )