题目内容
18.有A、B、C、D、E五种短周期元素,已知A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如右图所示.E的单质可与酸反应,1mol E单质与足量酸反应能产生22.4L H2(标准状况);E的阳离子与A的阴离子核外电子排布完全相同.回答下列问题:| A | ||
| B | C | D |
(2)元素A在化合物中一般显负(填正或负)价,但在与F(填元素符号)形成化合物时,所显示的价态正好相反.
(3)比较C、D元素简单离子半径的大小S2->Cl-(填离子符号).
(4)向D与E形成的化合物的水溶液中加入过量氨水,有关反应的离子方程式为Mg2++2 NH3.H2O═Mg (OH)2↓+2 NH4+.
(5)D的最高价氧化物对应的水化物与E的最高价氧化物对应的水化物反应的化学方程式为Mg(OH)2+2HClO4═Mg(ClO4)2+2H2O.
分析 A、B、C、D、E五种短周期元素,A、B、C、D四种元素原子核外共有56个电子,即这四种元素原子序数之和是56,设C的原子序数是x,则A的原子序数是x-8、B的原子序数是x-1、D的原子序数是x+1,
则x-8+x-1+x+x+1=56,x=16,所以A是O、B是P、C是S、D是Cl元素,
E的单质可与酸反应,1mol E单质与足量酸反应能产生22.4L H2(标准状况),则一个E原子失去2个电子,E的阳离子与A的阴离子核外电子排布完全相同,则E是Mg元素;
(1)主族元素原子核外电子层数等于其周期数、最外层电子数等于其族序数;
(2)A是O元素,在一般的化合物中显负电性,在和F元素形成的化合物中呈现正化合价;
(3)电子层结构相同的离子,离子半径随着原子序数增大而减小;
(4)D和E形成的化合物是氯化镁,一水合氨和氯化镁发生复分解反应;
(5)D的最高价氧化物的水化物是高氯酸,E的最高价氧化物的水化物是氢氧化镁,二者反应生成高氯酸镁和水.
解答 解:A、B、C、D、E五种短周期元素,A、B、C、D四种元素原子核外共有56个电子,即这四种元素原子序数之和是56,设C的原子序数是x,则A的原子序数是x-8、B的原子序数是x-1、D的原子序数是x+1,
则x-8+x-1+x+x+1=56,x=16,所以A是O、B是P、C是S、D是Cl元素,
E的单质可与酸反应,1mol E单质与足量酸反应能产生22.4L H2(标准状况),则一个E原子失去2个电子,E的阳离子与A的阴离子核外电子排布完全相同,则E是Mg元素;
(1)主族元素原子核外电子层数等于其周期数、最外层电子数等于其族序数,B是P元素,其原子核外有3个电子层、最外层电子数是5,所以位于第三周期第VA族,故答案为:第三周期第VA族;
(2)A是O元素,在一般的化合物中显负电性,在和F元素形成的化合物中呈现正化合价,故答案为:负;F;
(3)电子层结构相同的离子,离子半径随着原子序数增大而减小,所以离子半径大小顺序是S2->Cl-,故答案为:S2->Cl-;
(4)D和E形成的化合物是氯化镁,一水合氨和氯化镁发生复分解反应,离子方程式为Mg2++2 NH3.H2O═Mg(OH)2↓+2 NH4+,
故答案为:Mg2++2 NH3.H2O═Mg (OH)2↓+2 NH4+;
(5)D的最高价氧化物的水化物是高氯酸,E的最高价氧化物的水化物是氢氧化镁,二者反应生成高氯酸镁和水,反应方程式为Mg(OH)2+2 HClO4═Mg(ClO4)2+2 H2O,故答案为:Mg(OH)2+2 HClO4═Mg(ClO4)2+2 H2O.
点评 本题考查位置结构性质相互关系及应用,为高频考点,涉及离子半径大小比较、酸碱中和、元素在周期表中位置判断等知识点,正确判断元素是解本题关键,知道离子半径大小比较方法,题目难度不大.

 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案①单位时间内A、B生成C的分子数与分解C的分子数相等
②外界条件不变时,A、B、C浓度不随时间变化
③体系温度不再变化
④恒容条件下体系的压强不再变化
⑤体系的分子总数不再变化.
| A. | ①② | B. | ①②③ | C. | ①②③④ | D. | ①②③④⑤ |
| A. | KOH比NaOH碱性强 | |
| B. | H3BO3的酸性比H2CO3的酸性强 | |
| C. | HCl、H2S、H3P的还原性性逐渐减弱 | |
| D. | 若M+和R2-的核外电子层结构相同,则离子半径M+>R2- |
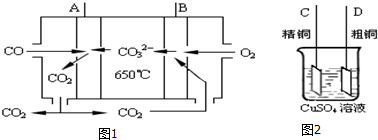
 ;
; ;
; .
.
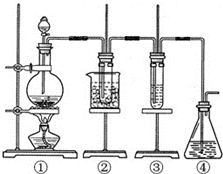 某学习小组设计了如图所示的实验方案来制取次氯酸钠和探究氯水的性质.图中:
某学习小组设计了如图所示的实验方案来制取次氯酸钠和探究氯水的性质.图中: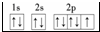 ;E3+的离子符号为Fe3+.
;E3+的离子符号为Fe3+.
 .
.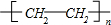 (或CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH).
(或CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH).