题目内容
7.图中 A、B、C、D、E、F、G 均为有机化合物.
根据上图回答问题:
(1)D的化学名称是乙醇.
(2)反应③的化学方程式是CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O.
(3)A的结构简式是
 .
.(4)G 是重要的工业原料,用化学方程式表示 G 的一种重要的工业用途nCH2=CH2$\stackrel{催化剂}{→}$
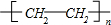 (或CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH).
(或CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH).
分析 B在浓硫酸加热条件下生成E,由E的结构可知,B发生酯化反应生成E,故B为 .D的分子式为C2H6O,一定条件下可以生成C2H4,故D为CH3CH2OH,E为CH2=CH2.C与CH3CH2OH在浓硫酸、加热条件下生成F,结合F的分子式C4H8O2可知,生成F的反应为酯化反应,故C为CH3COOH,F为CH3COOCH2CH3,A在氢氧化钠水溶液、加热条件下发生水解反应,酸化得到B、C、D,故A为
.D的分子式为C2H6O,一定条件下可以生成C2H4,故D为CH3CH2OH,E为CH2=CH2.C与CH3CH2OH在浓硫酸、加热条件下生成F,结合F的分子式C4H8O2可知,生成F的反应为酯化反应,故C为CH3COOH,F为CH3COOCH2CH3,A在氢氧化钠水溶液、加热条件下发生水解反应,酸化得到B、C、D,故A为
解答 解:B在浓硫酸加热条件下生成E,由E的结构可知,B发生酯化反应生成E,故B为 .D的分子式为C2H6O,一定条件下可以生成C2H4,故D为CH3CH2OH,E为CH2=CH2.C与CH3CH2OH在浓硫酸、加热条件下生成F,结合F的分子式C4H8O2可知,生成F的反应为酯化反应,故C为CH3COOH,F为CH3COOCH2CH3,A在氢氧化钠水溶液、加热条件下发生水解反应,酸化得到B、C、D,故A为
.D的分子式为C2H6O,一定条件下可以生成C2H4,故D为CH3CH2OH,E为CH2=CH2.C与CH3CH2OH在浓硫酸、加热条件下生成F,结合F的分子式C4H8O2可知,生成F的反应为酯化反应,故C为CH3COOH,F为CH3COOCH2CH3,A在氢氧化钠水溶液、加热条件下发生水解反应,酸化得到B、C、D,故A为
(1)由上述分析可知,D为CH3CH2OH,名称为乙醇,
故答案为:乙醇;
D的分子式为C2H6O,一定条件下可以生成C2H4,故D为CH3CH2OH,化学名称为乙醇,故答案为:乙醇;
(2)反应③是CH3COOH与CH3CH2OH发生酯化反应生成乙酸乙酯,反应方程式为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,
故答案为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;
(3)由上述分析可知,A的结构简式是
故答案为:
(4)乙烯可以合成聚乙烯,反应方程式为:nCH2=CH2$\stackrel{催化剂}{→}$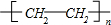 (或制备酒精,反应方程式为:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH),
(或制备酒精,反应方程式为:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH),
故答案为:nCH2=CH2$\stackrel{催化剂}{→}$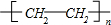 (或CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH).
(或CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH).
点评 本题考查有机物的推断,注意根据转化关系中E的结构以及D、G的分子式进行推断,掌握官能团的性质与转化是关键,难度中等.

| A | ||
| B | C | D |
(2)元素A在化合物中一般显负(填正或负)价,但在与F(填元素符号)形成化合物时,所显示的价态正好相反.
(3)比较C、D元素简单离子半径的大小S2->Cl-(填离子符号).
(4)向D与E形成的化合物的水溶液中加入过量氨水,有关反应的离子方程式为Mg2++2 NH3.H2O═Mg (OH)2↓+2 NH4+.
(5)D的最高价氧化物对应的水化物与E的最高价氧化物对应的水化物反应的化学方程式为Mg(OH)2+2HClO4═Mg(ClO4)2+2H2O.
| A. | 金属间在溶液中发生置换反应 | |
| B. | 1 mol金属单质在反应中失去电子的多少 | |
| C. | 金属元素的最高价氧化物的水化物的碱性强弱 | |
| D. | 金属单质与水或酸置换出氢气的难易 |
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
| A. | 锌电极为电流流出 | B. | 锌电极为正极 | ||
| C. | 锌电极有气泡 | D. | 反应中Zn被氧化 |
| A. | 根据能量守恒有Q1+Q2=2Q3 | |
| B. | 该反应中的能量变化为 ︳Q1+Q2-2Q3︳ | |
| C. | 若Q1+Q2>2Q3,则反应为放热反应 | |
| D. | 若1molA2和1molB2的总能量之和小于2molAB的总能量,则反应为放热反应 |
 在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:H2(g)+I2(g)?2HI(g)△H<0,反应中各物质的浓度随时间变化情况如图1:
在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:H2(g)+I2(g)?2HI(g)△H<0,反应中各物质的浓度随时间变化情况如图1: