题目内容
9.对于反应A(g)+B(g)?3C(g)(正反应为放热反应),下述为平衡状态标志的是( )①单位时间内A、B生成C的分子数与分解C的分子数相等
②外界条件不变时,A、B、C浓度不随时间变化
③体系温度不再变化
④恒容条件下体系的压强不再变化
⑤体系的分子总数不再变化.
| A. | ①② | B. | ①②③ | C. | ①②③④ | D. | ①②③④⑤ |
分析 反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,可由此进行判断.
解答 解:①单位时间内A、B生成C的分子数与分解C的分子数相等,说明正逆反应速率相等,反应达到平衡状态,故正确;
②外界条件不变时,A、B、C浓度不随时间变化,说明正逆反应速率相等,反应达到平衡状态,故正确;
③体系温度不再变化,说明正逆反应速率相等,反应达到平衡状态,故正确;
④反应前后气体物质的量不同,体系压强不再变化,说明各组分浓度不变,反应达到平衡状态,故正确;
⑤该反应前后分子总数不同,体系分子总数不再变化,说明正逆反应速率相等,反应达到平衡状态,故正确;
故选D.
点评 本题考查化学平衡状态的判断,题目难度不大,注意恒容容器和恒压容器的不同,注意平衡时的浓度关系、物质的量关系不能作为判断是否平衡的依据.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能源的新宠.已知该电池放电时的电极反应式为:正极 FePO4+Li++e-═LiFePO4,负极 Li-e═Li+.下列说法中正确的是( )
| A. | 充电时电池反应为FePO4+Li=LiFePO4 | |
| B. | 充电时动力电池上标注“+”的电极应与外接电源的正极相连 | |
| C. | 放电时电池内部Li+向负极移动 | |
| D. | 所用的电解质(溶液)为水(溶液) |
17.下列说法正确的是( )
| A. | 中和等体积、等物质的量浓度盐酸和醋酸溶液,盐酸所需NaOH溶液多于醋酸 | |
| B. | 常温下,20 LpH=12的Na2CO3溶液中含有的OH-离子数为0.2NA | |
| C. | 向0.1 mol/LCH3COOH溶液中加入少量CH3COONa固 体,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ 增大 | |
| D. | 一定温度下,10mL 0.50mol•L-1NH4Cl溶液与20mL 0.25mol•L-1NH4C1溶液含NH4+物质的量相同 |
4.下列离子方程式书写正确的是( )
| A. | 向NaHCO3溶液中加入足量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32- | |
| B. | 向亚硫酸钠溶液中滴入少量新制的氯水:3SO32-+Cl2+H2O=SO42-+2Cl-+2HSO3- | |
| C. | 电解KBr溶液时阴极的电极反应式为:K++e-=K | |
| D. | 将Fe2O3固体投入到少量HI溶液中:Fe2O3+6H++6I-=2Fe2++3I2+3H2O |
14.常温下,下列各组粒子一定能在指定溶液中大量共存的是( )
| A. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- | |
| B. | $\frac{{K}_{w}}{c({H}^{+})}$=1×10-13mol•L-1的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| D. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、AlO2-、CO32- |
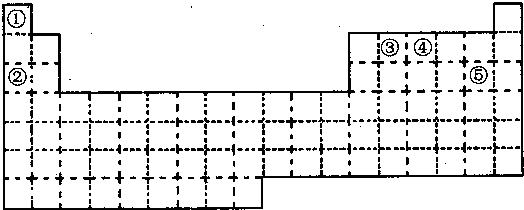
18.有A、B、C、D、E五种短周期元素,已知A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如右图所示.E的单质可与酸反应,1mol E单质与足量酸反应能产生22.4L H2(标准状况);E的阳离子与A的阴离子核外电子排布完全相同.回答下列问题:
(1)B在周期表中的位置为第三周期第VA族.
(2)元素A在化合物中一般显负(填正或负)价,但在与F(填元素符号)形成化合物时,所显示的价态正好相反.
(3)比较C、D元素简单离子半径的大小S2->Cl-(填离子符号).
(4)向D与E形成的化合物的水溶液中加入过量氨水,有关反应的离子方程式为Mg2++2 NH3.H2O═Mg (OH)2↓+2 NH4+.
(5)D的最高价氧化物对应的水化物与E的最高价氧化物对应的水化物反应的化学方程式为Mg(OH)2+2HClO4═Mg(ClO4)2+2H2O.
| A | ||
| B | C | D |
(2)元素A在化合物中一般显负(填正或负)价,但在与F(填元素符号)形成化合物时,所显示的价态正好相反.
(3)比较C、D元素简单离子半径的大小S2->Cl-(填离子符号).
(4)向D与E形成的化合物的水溶液中加入过量氨水,有关反应的离子方程式为Mg2++2 NH3.H2O═Mg (OH)2↓+2 NH4+.
(5)D的最高价氧化物对应的水化物与E的最高价氧化物对应的水化物反应的化学方程式为Mg(OH)2+2HClO4═Mg(ClO4)2+2H2O.