题目内容
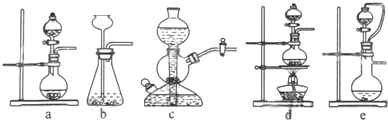
3.实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取SO2(1)若用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,图中可选用的发生装置是ae(填写字母)
(2)若用铜与浓硫酸反应制取SO2,如何观察产物CuSO4的生成待反应混合液冷却至室温,转移至盛有蒸馏水的烧杯中,看到溶液呈蓝色.
分析 (1)用硫酸和亚硫酸钠制取SO2的试剂为固态和液态,反应条件不需加热,可通过控制添加硫酸的速率来控制反应速率,结合装置可知a、e可达到目的;
(2)根据硫酸铜溶液显示蓝色分析,注意反应后的混合物中含有浓硫酸,不能将水加入混合液中,可以借用浓硫酸稀释的操作方法解答.
解答 解:(1)用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,由于反应不需要加热,排除装置d;由于亚硫酸钠是细小颗粒,不可选用装置c;装置b无法可知反应速率,故可选用的发生装置为:ae,
故答案为:ae;
(2)硫酸铜溶液显示蓝色,将反应后的溶液稀释后通过溶液颜色即可判断反应产物含有硫酸铜,由于混合液中含有浓硫酸,若向反应后的混合液中加入水,会导致液体飞溅,所以正确的操作方法为:待反应混合液冷却至室温,转移至盛有蒸馏水的烧杯中,看到溶液呈蓝色,
故答案为:待反应混合液冷却至室温,转移至盛有蒸馏水的烧杯中,看到溶液呈蓝色.
点评 本题考查气体发生装置的选择、浓硫酸的化学性质,题目难度不大,明确化学实验基本操作方法及常见气体发生装置特点为解答关键,注意明确浓硫酸的性质,试题侧重考查学生的化学实验能力.

练习册系列答案
相关题目
14.下列有机物的命名正确的是( )
| A. | 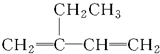 2-乙基-1,3-丁二烯 2-乙基-1,3-丁二烯 | B. | CH3CH2CH2CH2OH 丁醇 | ||
| C. |  甲苯 甲苯 | D. | HOCH2CH2CH2OH 1,3-二丙醇 |
12.下列实验中,不能观察到明显变化的是( )
| A. | 把Cl2通入FeCl2溶液中 | |
| B. | 把一段打磨过的镁带放入少量冷水中 | |
| C. | 把绿豆大的钾投入少量水中 | |
| D. | 把溴水滴加到淀粉KI溶液中 |
8.把4.6g钠投入到95.6g水中,不考虑水的蒸发,所得溶液中溶质的质量分数是( )
| A. | 4.6% | B. | 7.7% | C. | 8.0% | D. | 10% |
12.下列有关原子结构和元素周期律的表述正确的是( )
①原子序数为15的元素的原子半径小于N原子半径
②第ⅦA族元素是同周期中非金属性最强的元素
③第二周期第ⅣA族元素的氢化物的稳定性大于NH3
④原子序数为12的元素的最高价氧化物对应水化物的碱性大于Al(OH)3.
①原子序数为15的元素的原子半径小于N原子半径
②第ⅦA族元素是同周期中非金属性最强的元素
③第二周期第ⅣA族元素的氢化物的稳定性大于NH3
④原子序数为12的元素的最高价氧化物对应水化物的碱性大于Al(OH)3.
| A. | ①② | B. | ①③ | C. | ②④ | D. | ③④ |
13.向30mL1mol•L-1的AlCl3溶液中逐渐加入浓度为4mol•L-1的NaOH溶液,若产生0.78g白色沉淀,则加入的NaOH溶液的体积可能为( )
| A. | 3mL | B. | 10mL | C. | 15mL | D. | 27.5mL |
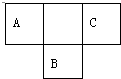 短周期元素的A、B、C在元素周期表中的位置如图所示,已知A、B、C三种元素的原子核外电子数之和等于B的质量数,B原子核内质子数和中子数相等.据此填空:
短周期元素的A、B、C在元素周期表中的位置如图所示,已知A、B、C三种元素的原子核外电子数之和等于B的质量数,B原子核内质子数和中子数相等.据此填空: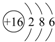
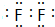 ,C的单质溶于水所得溶液叫:氢氟酸.
,C的单质溶于水所得溶液叫:氢氟酸.
 .
.