题目内容
7.下列各项中表达正确的是( )| A. | NH3分子的电子式: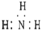 | B. | CH4分子的比例模型: | ||
| C. | O原子的结构示意图: | D. | N2的结构式:N≡N |
分析 A.氨气分子中的N原子上有1对孤对电子;
B.图中为甲烷的球棍模型;
C.氧原子原子序数为8,核外有2个电子层,最外层有6个电子;
D.用短线“-”代替共用电子对即为结构式,氮气中存在三对共价键.
解答 解:A.NH3分子的电子式为 ,故A错误;
,故A错误;
B.CH4分子的比例模型为 ,
, 为甲烷的球棍模型,故B错误;
为甲烷的球棍模型,故B错误;
C.氧原子原子序数为8,核外有2个电子层,最外层有6个电子,O原子结构示意图为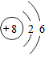 ,故C错误;
,故C错误;
D.N原子之间形成三对共用电子对,结构式只把共用电子对用短线表示,未成键的电子不画出,N2的结构式为N≡N,故D正确,
故选D.
点评 本题考查常用化学用语的书写,难度不大,掌握常用化学用语的书写,注意未成键的孤对电子对容易忽略.

练习册系列答案
相关题目
17.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )
| A. | 元素A、B只能形成一种化合物 | |
| B. | 一定条件下,元素C、D的最高价氧化物对应的水化物之间不能发生反应 | |
| C. | 工业上常用电解法制备元素C、D的单质 | |
| D. | 化合物AE与CE含有相同类型的化学键 |
18.下列化学用语使用正确的是( )
| A. | 甲烷的球棍模型为 | B. | 乙醇的分子式为C2H3CH2OH | ||
| C. | 邻甲基苯酚的结构简式为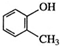 | D. | 聚乙烯的结构简式为CH2=CH2 |
12.下列实验中,不能观察到明显变化的是( )
| A. | 把Cl2通入FeCl2溶液中 | |
| B. | 把一段打磨过的镁带放入少量冷水中 | |
| C. | 把绿豆大的钾投入少量水中 | |
| D. | 把溴水滴加到淀粉KI溶液中 |
16.关于NO的下列叙述,不正确的是( )
| A. | NO可以是某些含低价氮物质的氧化产物 | |
| B. | NO可以是某些含高价氮物质的还原产物 | |
| C. | 已知亚硝酸钠的化学式是NaNO2,则NO不是亚硝酸酐 | |
| D. | NO2和NO都是红棕色气体 |
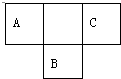 短周期元素的A、B、C在元素周期表中的位置如图所示,已知A、B、C三种元素的原子核外电子数之和等于B的质量数,B原子核内质子数和中子数相等.据此填空:
短周期元素的A、B、C在元素周期表中的位置如图所示,已知A、B、C三种元素的原子核外电子数之和等于B的质量数,B原子核内质子数和中子数相等.据此填空: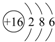
 ,C的单质溶于水所得溶液叫:氢氟酸.
,C的单质溶于水所得溶液叫:氢氟酸.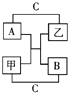 A、B、C是短周期里的3种元素的单质,甲、乙是常见的化合物,它们之间 存在如下关系:若A为单质有色气体,请判断:(填化学式)A是Cl2,B是S,C是H2,甲是H2S,乙是HCl.
A、B、C是短周期里的3种元素的单质,甲、乙是常见的化合物,它们之间 存在如下关系:若A为单质有色气体,请判断:(填化学式)A是Cl2,B是S,C是H2,甲是H2S,乙是HCl.
 .
.