题目内容
5.下列各组溶液中,不用任何试剂无法鉴别的是( )| A. | NaCl、Na2CO3、NaI、AgNO3 | B. | HCl、Na2CO3、新制氯水、NaI | ||
| C. | Na2S、HCl、FeCl3、NaCl | D. | AlCl3、BaCl2、Na2CO3、H2SO4 |
分析 A.NaCl、Na2CO3均与AgNO3反应生成白色沉淀;
B.氯水为浅黄色,Na2CO3与HCl反应生成气体,氯气与NaI生成紫色的碘水;
C.FeCl3为黄色,FeCl3与Na2S反应生成沉淀,Na2S与HCl反应生成臭鸡蛋气味的气体;
D.BaCl2与Na2CO3、H2SO4反应生成白色沉淀,但碳酸钡能溶于酸,AlCl3与Na2CO3相互促进水解生成沉淀和气体.
解答 解:A.NaCl、Na2CO3均与AgNO3反应生成白色沉淀,且与相互之间及与NaI均不反应,不能鉴别NaCl、Na2CO3,故A选;
B.氯水为浅黄色,与氯水反应生成气体的为Na2CO3,与氯水反应颜色变深的为NaI,剩余物质中与Na2CO3与反应生成气体的HCl,可鉴别,故B不选;
C.FeCl3为黄色,与FeCl3反应生成沉淀的为Na2S,与Na2S反应生成臭鸡蛋气味的气体的为HCl,剩余一种为NaCl,可鉴别,故C不选;
D.BaCl2与Na2CO3、H2SO4反应生成白色沉淀,再加试剂能溶解沉淀且生成气体时,加入物质为H2SO4,然后可确定BaCl2、Na2CO3,AlCl3与Na2CO3相互促进水解生成沉淀和气体,可鉴别,故D不选;
故选A.
点评 本题考查物质鉴别和检验,为高频考点,把握物质的性质、发生的反应及不同现象为解答的关键,注意常见试剂的颜色,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.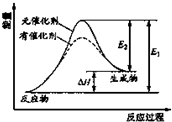 某反应的过程中能量辩护如图实数(图中E1表示正反应的活化能,E2表示逆反应的活化能),下列叙述制取的是( )
某反应的过程中能量辩护如图实数(图中E1表示正反应的活化能,E2表示逆反应的活化能),下列叙述制取的是( )
 某反应的过程中能量辩护如图实数(图中E1表示正反应的活化能,E2表示逆反应的活化能),下列叙述制取的是( )
某反应的过程中能量辩护如图实数(图中E1表示正反应的活化能,E2表示逆反应的活化能),下列叙述制取的是( )| A. | 该反应为放热反应 | |
| B. | 催化解能改变反应的焓变 | |
| C. | 催化解能降低反应所需活化能,增大活化分子百分数 | |
| D. | 逆反应的活化能大于正反应的活化能 |
13.下列关于 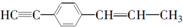 的说法中正确的是( )
的说法中正确的是( )
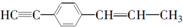 的说法中正确的是( )
的说法中正确的是( )| A. | 有7个碳原子可能在同一直线上 | |
| B. | 只可能有5个碳原子在同一直线上 | |
| C. | 最多只可能有9个碳原子在同一平面上 | |
| D. | 所有原子都可能在同一平面上 |
20.已知NH3分子可与Cu2+形成配合物离子[Cu(NH3)4]2+,则除去硫酸铜溶液中少量硫酸可选用的试剂是( )
| A. | NaOH | B. | NH3•H2O | C. | CuO | D. | BaCl2 |
10.下列各组离子,能在溶液中大量共存的是( )
| A. | NH4+、Na+、OH-、SO42- | B. | NH4+、Mg2+、NO3-、Cl- | ||
| C. | Ba2+、OH-、Cl-、SO42- | D. | Fe2+、H+、Cl-、NO3- |
17.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )
| A. | 元素A、B只能形成一种化合物 | |
| B. | 一定条件下,元素C、D的最高价氧化物对应的水化物之间不能发生反应 | |
| C. | 工业上常用电解法制备元素C、D的单质 | |
| D. | 化合物AE与CE含有相同类型的化学键 |
14.下列有机物的命名正确的是( )
| A. | 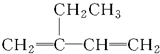 2-乙基-1,3-丁二烯 2-乙基-1,3-丁二烯 | B. | CH3CH2CH2CH2OH 丁醇 | ||
| C. |  甲苯 甲苯 | D. | HOCH2CH2CH2OH 1,3-二丙醇 |
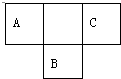 短周期元素的A、B、C在元素周期表中的位置如图所示,已知A、B、C三种元素的原子核外电子数之和等于B的质量数,B原子核内质子数和中子数相等.据此填空:
短周期元素的A、B、C在元素周期表中的位置如图所示,已知A、B、C三种元素的原子核外电子数之和等于B的质量数,B原子核内质子数和中子数相等.据此填空: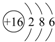
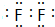 ,C的单质溶于水所得溶液叫:氢氟酸.
,C的单质溶于水所得溶液叫:氢氟酸.