题目内容
18.20g AO32-中核外电子数比质子数多0.5NA(NA代表阿伏加德罗常数)个,则元素A的相对原子质量为( )| A. | 12 | B. | 32 | C. | 60 | D. | 80 |
分析 根据n=$\frac{N}{{N}_{A}}$计算核外电子与质子的物质的量之差,而AO32-离子中核外电子数与质子数之差为2,进而计算AO32-离子的物质的量,再根据M=$\frac{m}{n}$计算AO32-离子的摩尔质量,进而计算A的相对原子质量.
解答 解:AO32-离子核外电子与质子的物质的量之差为$\frac{0.5{N}_{A}}{{N}_{A}mo{l}^{-1}}$=0.5mol,
而AO32-离子中核外电子数与质子数之差为2,则AO32-离子的物质的量为$\frac{0.5mol}{2}$=0.25mol,
故AO32-离子的摩尔质量为$\frac{20g}{0.25mol}$=80g/mol,
故A的相对原子质量为80-16×3=32,
故选B.
点评 本题考查物质的量有关计算,难度不大,侧重考查学生分析计算能力,注意对基础知识的理解掌握.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
6.下列结论是从某同学的作业本上摘录的,其中你认为肯定正确的是( )
①微粒半径:S2->Cl>S
②氢化物的稳定性:HF>HCl>H2S
③还原性:S2->Cl->Br-
④氧化性:Cl2>S>Se
⑤酸性:H2SO4>HClO4>H2SeO4
⑥得电子能力:F>Cl>S.
①微粒半径:S2->Cl>S
②氢化物的稳定性:HF>HCl>H2S
③还原性:S2->Cl->Br-
④氧化性:Cl2>S>Se
⑤酸性:H2SO4>HClO4>H2SeO4
⑥得电子能力:F>Cl>S.
| A. | ①⑤ | B. | ①③④ | C. | ②④⑥ | D. | ⑥ |
3.下列关于化学反应速率的说法正确的是( )
| A. | 化学反应速率是指一定时间内任何一种反应物浓度的减小或任何一种生成物浓度的增加 | |
| B. | 化学反应速率为0.8 mol/(L•s)是指1s时某物质的浓度为0.8mol/L | |
| C. | 根据化学反应速率的大小可以知道化学反应的相对快慢 | |
| D. | 对于任何化学反应来说,反应速率越大,反应现象越明显 |
10.扑热息痛是一种解热镇痛药,结构式为 .下列说法中错误的是( )
.下列说法中错误的是( )
 .下列说法中错误的是( )
.下列说法中错误的是( )| A. | 扑热息痛的分子式为C8H9NO2 | |
| B. | 扑热息痛可与烧碱溶液、浓溴水溶液发生反应 | |
| C. | 扑热息痛很稳定,不容易被氧化 | |
| D. | 扑热息痛核磁共振氢谱上有5个峰,峰面积之比为1:1:2:2:3 |
7.下列化合物中,所有原子不可能在同一平面的是( )
| A. | 四氯化碳 | B. | 溴苯 | C. | 苯乙烯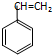 | D. | 四氯乙烯 |
8.下列烷烃的一氯代物中没有同分异构体的是( )
| A. | 2,2-二甲基丙烷 | B. | 2-甲基丙烷 | C. | 丙烷 | D. | 丁烷 |