题目内容
17.有关原子最外层电子排布为(n+1)sn(n+1)pn+1的元素及其化合物,下列叙述中不正确的是( )| A. | 氢化物不稳定 | |
| B. | 最高价氧化物对应的水化物是一种强酸 | |
| C. | 其单质既有氧化性又有还原性 | |
| D. | 是植物生长所需要的一种营养元素 |
分析 由于p能级已经有电子,因此同能层的s能级上电子应为2,即n=2,则该价电子结构实际为3s23p3,是磷元素,以此分析.
解答 解:由于p能级已经有电子,因此同能层的s能级上电子应为2,即n=2,则该价电子结构实际为3s23p3,是磷元素,
A、磷化氢不稳定,受热易分解,故A正确;
B、P的最高价氧化物对应的水化物是磷酸,为弱酸,故B错误;
C、P单质的化合价处于中间价态,既有氧化性又有还原性,故C正确;
D、磷元素是植物生长的营养素,故D正确;
故选:B.
点评 本题考查了原子核外电子排布、元素及化合物的性质,具有一定的综合性,难度不大,推断出元素种类是解题的关键.

练习册系列答案
相关题目
7.用中和滴定法测量某烧碱的纯度,试根据实验步骤填写下列空白:
(1)配制待测溶液,将4.21g含有少量不与盐酸反应的杂质的NaOH固体配成250.00mL待测液,需用到的仪器有烧杯、玻璃棒、胶头滴管、250mL 容量瓶.
(2)把0.4mol•L-1的标准盐酸溶液注入洁净的酸式滴定管中,使液面刻度在“0”以上,固定后,轻轻旋转活塞使滴定管尖嘴部分充满溶液,然后调整液面保持在0刻度或0刻度以下,记下读数;用碱式滴定管向锥形瓶中加入20.00mL待测溶液,并加几滴甲基橙作指示剂.
(3)实验数据
根据上表中的数据,可求得NaOH固体的纯度为95%.
(4)误差分析,若滴定前仰视酸式滴定管读数,终点读法正确,其测得结果偏低(偏高、偏低)
(1)配制待测溶液,将4.21g含有少量不与盐酸反应的杂质的NaOH固体配成250.00mL待测液,需用到的仪器有烧杯、玻璃棒、胶头滴管、250mL 容量瓶.
(2)把0.4mol•L-1的标准盐酸溶液注入洁净的酸式滴定管中,使液面刻度在“0”以上,固定后,轻轻旋转活塞使滴定管尖嘴部分充满溶液,然后调整液面保持在0刻度或0刻度以下,记下读数;用碱式滴定管向锥形瓶中加入20.00mL待测溶液,并加几滴甲基橙作指示剂.
(3)实验数据
| 试验编号 | 待测液的体积(mL) | 滴入0.4000mol•L-1盐酸的体积(mL) | |
| 滴定前(mL) | 滴定后(mL) | ||
| 1 | 20.00 | 2.10 | 22.00 |
| 2 | 20.00 | 0.90 | 21.00 |
(4)误差分析,若滴定前仰视酸式滴定管读数,终点读法正确,其测得结果偏低(偏高、偏低)
5.设NA为阿伏加德罗常数,下列叙述中正确的是( )
| A. | 常温下,11.2L的甲烷气体含有甲烷分子数为0.5 NA | |
| B. | 14g乙烯和丙烯的混合物中总原子数为3 NA | |
| C. | 标准状况下,22.4 L氯仿中含有的氯原子数目为3 NA | |
| D. | 17.6 g丙烷中所含的极性共价键为4 NA |
12.下列说法中正确的是( )
| A. | 硫酸分子中既存在一般的共价键,同时还有配位键 | |
| B. | 1个氮气分子中含有2个σ键和1个π键 | |
| C. | 能够用来衡量化学键强弱的物理量有:原子化热、晶格能、键能、氢键等 | |
| D. | NH4+中4个N-H键的键能不相同 |
2.以下化学用语正确的是( )
| A. | 一CH3(甲基)的电子式为 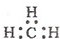 | B. | 硝基苯的结构简式: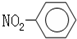 | ||
| C. | 甲醛的结构式: | D. | 乙醇的分子式:CH3CH2OH |
6.下列结论是从某同学的作业本上摘录的,其中你认为肯定正确的是( )
①微粒半径:S2->Cl>S
②氢化物的稳定性:HF>HCl>H2S
③还原性:S2->Cl->Br-
④氧化性:Cl2>S>Se
⑤酸性:H2SO4>HClO4>H2SeO4
⑥得电子能力:F>Cl>S.
①微粒半径:S2->Cl>S
②氢化物的稳定性:HF>HCl>H2S
③还原性:S2->Cl->Br-
④氧化性:Cl2>S>Se
⑤酸性:H2SO4>HClO4>H2SeO4
⑥得电子能力:F>Cl>S.
| A. | ①⑤ | B. | ①③④ | C. | ②④⑥ | D. | ⑥ |
7.下列化合物中,所有原子不可能在同一平面的是( )
| A. | 四氯化碳 | B. | 溴苯 | C. | 苯乙烯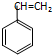 | D. | 四氯乙烯 |