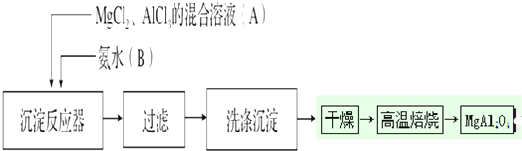
题目内容
16.如图是工业上处理含苯酚的废水并对其加以回收利用的工业流程:
回答下列问题:
(1)设备①进行的是操作萃取分液(写操作名称);
(2)由设备②进入设备③的物质A是C6H5ONa,由设备③进入设备④的物质B是NaHCO3;
(3)在设备③中发生反应的化学方程式为C6H5ONa+CO2+H2O→C6H5OH+NaHCO3;
(4)在设备④中,物质B、的水溶液和CaO反应,产物是CaCO3、NaOH和水,可通过过滤操作(填写操作名称)分离产物;
(5)图中,能循环使用的物质是C6H6、CaO、NaOH水溶液、CO2.
分析 由流程图和每一步新加的试剂进行分析可知:用苯萃取出设备①中的苯酚进入设备②,然后用NaOH溶液将设备②中的苯酚转化为苯酚钠而进入设备③,向设备③中通入CO2将苯酚钠转化为苯酚,同时生成NaHCO3而进入设备④,向设备④中加入CaO时,生成CaCO3进入设备⑤,NaOH进入设备②循环使用,以此分析解答.
解答 解:由流程图和每一步新加的试剂进行分析可知:用苯萃取出设备①中的苯酚进入设备②,然后用NaOH溶液将设备②中的苯酚转化为苯酚钠而进入设备③,向设备③中通入CO2将苯酚钠转化为苯酚,同时生成NaHCO3而进入设备④,向设备④中加入CaO时,生成CaCO3进入设备⑤,NaOH进入设备②循环使用,
(1)根据以上分析,用苯萃取出设备①中的苯酚进入设备②,所以设备①进行的是操作是萃取,分液,故答案为:萃取分液;
(2)根据以上分析,用NaOH溶液将设备②中的苯酚转化为苯酚钠而进入设备③,向设备③中通入CO2将苯酚钠转化为苯酚,同时生成NaHCO3而进入设备④,所以A是C6H5ONa,B是NaHCO3,故答案为:C6H5ONa;NaHCO3;
(3)根据以上分析,向设备③中通入CO2将苯酚钠转化为苯酚,方程式为:C6H5ONa+CO2+H2O→C6H5OH+NaHCO3,故答案为:C6H5ONa+CO2+H2O→C6H5OH+NaHCO3;
(4)根据(2)在设备④中,物质B的水溶液即NaHCO3和CaO反应CaCO3、NaOH和水,再通过过滤分离出碳酸钙;故答案为:CaCO3、过滤;
(5)能循环使用的物质是在流程中生成的副产物,并且在流程中需要加入的原料,根据流程图中箭头指向,很容易发现能循环使用的物质是C6H6、CaO、NaOH水溶液、CO2,故答案为:NaOH水溶液;CO2.
点评 本题主要考查对流程图的分析,涉及有机物混合物分离提纯等,侧重分析能力及知识迁移应用能力的考查,综合性较强,题目难度中等.注意苯酚钠和二氧化碳反应只能生成碳酸氢钠和苯酚.

(1)配制待测溶液,将4.21g含有少量不与盐酸反应的杂质的NaOH固体配成250.00mL待测液,需用到的仪器有烧杯、玻璃棒、胶头滴管、250mL 容量瓶.
(2)把0.4mol•L-1的标准盐酸溶液注入洁净的酸式滴定管中,使液面刻度在“0”以上,固定后,轻轻旋转活塞使滴定管尖嘴部分充满溶液,然后调整液面保持在0刻度或0刻度以下,记下读数;用碱式滴定管向锥形瓶中加入20.00mL待测溶液,并加几滴甲基橙作指示剂.
(3)实验数据
| 试验编号 | 待测液的体积(mL) | 滴入0.4000mol•L-1盐酸的体积(mL) | |
| 滴定前(mL) | 滴定后(mL) | ||
| 1 | 20.00 | 2.10 | 22.00 |
| 2 | 20.00 | 0.90 | 21.00 |
(4)误差分析,若滴定前仰视酸式滴定管读数,终点读法正确,其测得结果偏低(偏高、偏低)
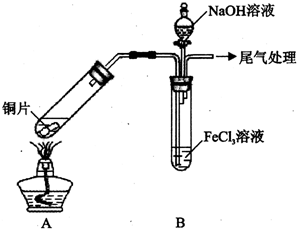 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示(夹持仪器已略去).
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示(夹持仪器已略去).(1)实验前,应先检查装置的气密性;实验中产生的尾气应通人NaOH溶液.
(2)实验过程中需要配制100mL1mol/L FeCl3溶液(未用浓盐酸酸化),所需要的玻璃仪器有:烧杯、量筒、玻璃棒、胶头滴管、100mL的容量瓶.
(3)该小组同学向5mL lmol/L FeCl3溶液中通人足量的SO2,溶液最终呈浅绿色,再打开分液漏斗活塞,逐滴加入NaOH稀溶液,则试管B中产生的实验现象是开始无现象,然后产生白色沉淀.
(4)该小组同学在(3)中实验时,发现溶液变为浅绿色需要较长时间,在此期间同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象,最终溶液呈浅绿色.
【查阅资料】Fe( HSO3)2+离子在溶液中呈红棕色且具有较强的还原性,能被Fe3+氧化为SO${\;}_{4}^{2-}$.Fe(HSO3)2+与Fe3+在溶液中反应的离子方程式是Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+.
(5)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了如下实验:
| 步骤② | 往5mL 1mol•LFeCl3溶液中通入SO2气体,溶液立即变为红棕色.微热在较短时间内溶液颜色变为浅绿色. |
| 步骤③ | 往5mL重新配制的1mol•L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色.短时间内发现溶液颜色变成浅绿色. |
(6)综合上述实验探究过程,可以获得的实验结论:
I.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ.加热、提高FeCl3溶液的酸性会缩短浅绿色出现的时间.
| A. | 常温下,11.2L的甲烷气体含有甲烷分子数为0.5 NA | |
| B. | 14g乙烯和丙烯的混合物中总原子数为3 NA | |
| C. | 标准状况下,22.4 L氯仿中含有的氯原子数目为3 NA | |
| D. | 17.6 g丙烷中所含的极性共价键为4 NA |
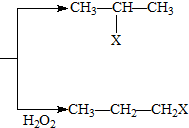 (X为卤素原子)
(X为卤素原子)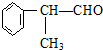 的物质,该物质是一种香料.
的物质,该物质是一种香料.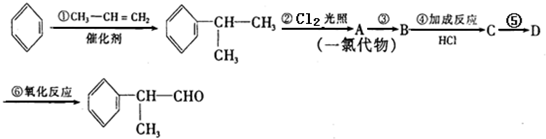
 .
.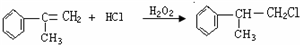 .
.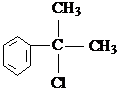 的水解产物
的水解产物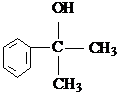 不能经氧化反应⑥而得到产品.
不能经氧化反应⑥而得到产品.