题目内容
3.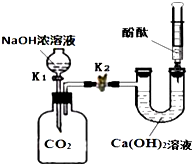 某兴趣小组在探究二氧化碳与氢氧化钠溶液反应的实验中,做了如图所示的实验.
某兴趣小组在探究二氧化碳与氢氧化钠溶液反应的实验中,做了如图所示的实验.(1)将足量的氢氧化钠浓溶液装入分液漏斗中,先打开阀门K1,广口瓶中发生反应的化学方程式为2NaOH+CO2=Na2CO3+H2O,待氢氧化钠溶液完全进入广口瓶之后立即关闭K1,充分反应后,打开止水夹K2,观察到的现象是U型管中的溶液有部分沿导管进入广口瓶,广口瓶中出现浑浊,注射器中的液体自动喷入U型管,且变为红色,产生上述现象的主要原因是:二氧化碳与氢氧化钠反应,瓶内压强减小.
(2)同学们将实验后的废液倒入烧杯中并过滤,取滤液于试管中加入足量的稀盐酸,无气泡产生,说明废液中的溶质为NaOH或NaOH和Ca(OH)2(写出所有可能).
分析 (1)打开阀门K1后,氢氧化钠溶液与二氧化碳反应生成碳酸钠和水,据此写出反应的化学方程式;关闭K1,充分反应后打开止水夹K2,由于二氧化碳与氢氧化钠反应,瓶内压强减小,导致U型管中的溶液有部分沿导管进入广口瓶,广口瓶中出现浑浊,注射器中的液体自动喷入U型管,且U形管中溶液变为红色;
(2)滤液于试管中加入足量的稀盐酸,无气泡产生,说明溶质中不含碳酸钠,应该含有氢氧化钠或氢氧化钠和氢氧化钙的混合物.
解答 解:(1)二氧化碳为酸性氧化物,能够与氢氧化钠溶液反应,当打开阀门K1后,广口瓶中二氧化碳与氢氧化钠溶液反应生成碳酸钠和水,反应的化学方程式为:2NaOH+CO2=Na2CO3+H2O;
待氢氧化钠溶液完全进入广口瓶之后立即关闭K1,充分反应后,打开止水夹K2,由于二氧化碳与氢氧化钠反应,集气瓶中气体体积减小,则瓶内压强减小,导致U型管中的溶液有部分沿导管进入广口瓶,广口瓶中出现浑浊,注射器中的液体自动喷入U型管;U形管中的氢氧化钙溶液遇到酚酞变为红色,
故答案为:2NaOH+CO2=Na2CO3+H2O;U型管中的溶液有部分沿导管进入广口瓶,广口瓶中出现浑浊,注射器中的液体自动喷入U型管,且变为红色;二氧化碳与氢氧化钠反应,瓶内压强减小;
(2)将实验后的废液倒入烧杯中并过滤,取滤液于试管中加入足量的稀盐酸,无气泡产生,说明滤液中不含碳酸钠,则原反应物中氢氧化钠过量,反应后的废液中含有的溶质为:NaOH或NaOH和Ca(OH)2,
故答案为:NaOH或NaOH和Ca(OH)2.
点评 本题考查了性质实验方案的设计,题目难度中等,明确实验目的及二氧化碳气体的性质为解答关键,注意掌握性质实验方案设计的原则,试题培养了学生的分析、理解能力及灵活应用基础知识的能力.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
4.水中的HgCl2在微生物作用下,能产生毒性更大的有机物:
HgCl2+CH4$\stackrel{微生物}{→}$CH3HgCl+HCl ①水中的NH3在微生物作用下发生如下变化:2NH3+3O2$\stackrel{微生物}{→}$2HNO2+2H2O ②2HNO2+O2$\stackrel{微生物}{→}$2HNO3 ③
下列说法不正确的是 ( )
HgCl2+CH4$\stackrel{微生物}{→}$CH3HgCl+HCl ①水中的NH3在微生物作用下发生如下变化:2NH3+3O2$\stackrel{微生物}{→}$2HNO2+2H2O ②2HNO2+O2$\stackrel{微生物}{→}$2HNO3 ③
下列说法不正确的是 ( )
| A. | 反应①是取代反应,反应②③是氧化还原反应 | |
| B. | 水中溶解的NH3会导致水生动物死亡 | |
| C. | 向氨超标的河水中加稀硫酸是一种行之有效的处理方法 | |
| D. | 自来水中的HgCl2可加入Na2S处理 |
15.下列各组混合物中,能用分液漏斗进行分离的是( )
| A. | 水和四氯化碳 | B. | 碘和四氯化碳 | C. | 酒精和水 | D. | 汽油和植物油 |
12.下列说法中正确的是( )
| A. | 硫酸分子中既存在一般的共价键,同时还有配位键 | |
| B. | 1个氮气分子中含有2个σ键和1个π键 | |
| C. | 能够用来衡量化学键强弱的物理量有:原子化热、晶格能、键能、氢键等 | |
| D. | NH4+中4个N-H键的键能不相同 |

