题目内容
3.设NA是阿伏加德罗常数的值,下列说法正确的是( )| A. | 标准状况下,22.4L乙醇中含有的氧原子数为NA | |
| B. | 标准状况下,22.4L37Cl2中所含中子数为40NA | |
| C. | 将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NA个Fe3+ | |
| D. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有OH-数目为0.2NA |
分析 A、标况下,乙醇是液体,无法根据体积计算出乙醇的物质的量及含有的氧原子数目;
B、根据氯气的体积计算出氯气的物质的量,再根据37Cl2中所含中子数计算出氯气中含有的中子的物质的量及数目;
C、氯化铁溶液中铁离子部分水解,导致铁离子数目减少;
D、根据溶液的pH计算出氢氧化钡溶液中氢氧根离子的浓度,再计算出氢氧化钡溶液中氢氧根离子的物质的量及数目.
解答 解:A、在标准状况下,乙醇不是气体,无法计算22.4L乙醇的物质的量,也就无法计算乙醇中含有氧原子数目,故A错误;
B、标况下,22.4L氯气的物质的量为1mol,1mol37Cl2中所含中子的物质的量为40mol,所含中子数为40NA,故B错误;
C、由于溶液中铁离子部分水解,将0.1mol氯化铁溶于1L水中,所得溶液含有铁离子物质的量小于0.1mol,铁离子数目小于0.1NA个,故C错误;
D、常温下pH=13的1.0LBa(OH)2溶液中,氢氧根离子浓度为0.1mol/L,1L该溶液中含有0.1mol氢氧根离子,含有的OH-数目为0.1NA,故D正确;
故选D.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,阿伏加德罗常数是高考的“热点”,既考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,又可以涵盖多角度的化学知识内容.要准确解答好这类题目,既要掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,还要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.下列分子和离子中中心原子VSEPR模型为四面体形,且分子或离子空间的构型为V形的是( )
| A. | NH4+ | B. | PH3 | C. | H3O+ | D. | OF2 |
18.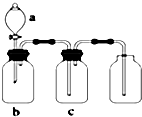 用如图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
用如图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
 用如图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
用如图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )| 气体 | a | b | c | |
| A | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
| B | SO2 | 浓硫酸 | 铜片 | 酸性高锰酸钾溶液 |
| C | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| D | CO2 | 稀盐酸 | 大理石 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
8.下列叙述正确的是( )
| A. | 用标准的盐酸溶液滴定含甲基橙的氢氧化钠溶液,终点时溶液由黄色变成橙色 | |
| B. | 将二氧化硫通入氯化钡溶液中产生白色沉淀,再滴加稀硝酸沉淀不消失 | |
| C. | 向葡萄糖溶液中加入新制氢氧化铜,加热至沸腾,静置后上层溶液呈红色 | |
| D. | 海水提取溴的过程不发生氧化还原反应 |
15.足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与3.2g O2混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入NaOH溶液至Cu2+恰好完全沉淀,则消耗溶液中NaOH的质量是( )
| A. | 16g | B. | 32g | C. | 64g | D. | 无法计算 |
12.下列不属于晶体特点的是( )
| A. | 有固定的几何外形 | B. | 一定有各向异性 | ||
| C. | 一定有固定的熔点 | D. | 一定是无色透明的固体 |
13.下列关于有机物结构、性质的说法正确的是( )
| A. | 石油的分馏、裂化和煤的气化、液化、干馏都是化学变化 | |
| B. | 乙烯和苯都能与氢气发生加成反应,说明二者分子中所含碳碳键相同 | |
| C. | 甲烷、苯、乙醇、乙酸乙酯在一定条件下都能发生取代反应 | |
| D. | 蔗糖、油脂、蛋白质都能发生水解反应,都属于天然有机高分子化合物 |
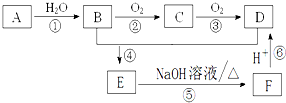 已知:A是石油裂解气的主要成份且A的产量通常用来衡量一个国家的石油化工水平;请回答下列问题:
已知:A是石油裂解气的主要成份且A的产量通常用来衡量一个国家的石油化工水平;请回答下列问题: